
����Ŀ����ѧ����С����������װ�����ϵ��ʵ�飮��ش��������⣺
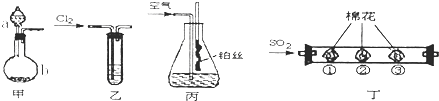
��1��װ�ü�������a������Ϊ___ �� ��װ�ü���ȡNH3 �� ��b�м���CaO���壬a�м���Ũ��ˮ��д����Ӧ�Ļ�ѧ����ʽ��___ ��
��2����C12����ͨ��װ�е���һKI��ɫ��Һ��װ�����У���Һ������������ɫ���������ϵ�֪����Һ��ɫ����ɫ������Ϊ��+5�۵ĵ�Ԫ�����ɣ���д���÷�Ӧ�����ӷ���ʽ��___ ��
��3����װ�ñ�ģ�⡰���Ĵ�������ʵ�飮��ƿ��װ��Ũ��ˮ��ͨ��������������ȵIJ�˿������ƿ�ڣ���˿���ֺ��ȣ���˿���ֺ��ȵ�ԭ����___����ƿ�ڻ��ɹ۲쵽������___ ��
��4���С��ӡ���ɫ��ѧ���Ƕȳ�������װ�ö��н� ��SO2������ʵ�飮��������պ�в�ͬ�Լ�������д���пհף�
��� | �� | �� | �� |
����պ�е��Լ� | Ʒ����Һ | ���Ը��������Һ | ___ |
���� | ___ | ��Һ��ɫ��ȥ | �� |
���� | SO2����Ư���� | SO2����___ | SO2�ж��������ſ� |
���𰸡���Һ©��CaO+NH3![]() H2O=Ca��OH��2+NH3��5Cl2+I2+6H2O=10Cl��+2IO3��+12H+���Ĵ���Ӧ�Ƿ��ȷ�Ӧ�к���ɫ�������������������Ũ��Һ��ɫ��ԭ��
H2O=Ca��OH��2+NH3��5Cl2+I2+6H2O=10Cl��+2IO3��+12H+���Ĵ���Ӧ�Ƿ��ȷ�Ӧ�к���ɫ�������������������Ũ��Һ��ɫ��ԭ��
��������
(1)��װ��ͼ����֪��aΪ��Һ©����CaO����ˮ��Ӧ����������������Ӧ�ų��������ٽ������Ļӷ���
(2)�����������֪��������KI��Ӧ����KIO3��
(3)��˿���ֺ�����˵�����Ĵ���ӦΪ���ȷ�Ӧ������NO������������Ӧ���ɺ���ɫ�Ķ���������
(4)�����������Ư��������ʹƷ����ɫ�����л�ԭ�����������Ը�����ط���������ԭ��Ӧ,Ϊ��������������Ӧ��
(1)��װ��ͼ����֪��aΪ��Һ©����CaO����ˮ��Ӧ����������������Ӧ�ų��������ٽ������Ļӷ�����Ӧ�ķ���ʽΪCaO+NH3![]() H2O=Ca(OH��2+NH3����
H2O=Ca(OH��2+NH3����
��ˣ�������ȷ��������Һ©����CaO+NH3![]() H2O=Ca(OH��2+NH3����
H2O=Ca(OH��2+NH3����
(2)�����������֪��������KI��Ӧ����KIO3,��Ӧ�����ӷ���ʽΪ5Cl2+I2+6H2O=10Cl��+2IO3��+12H+ ��
��ˣ�������ȷ������5Cl2+I2+6H2O=10Cl��+2IO3��+12H+ ��
(3)��˿���ֺ�����˵�����Ĵ���ӦΪ���ȷ�Ӧ������NO������������Ӧ���ɺ���ɫ�Ķ�������������������ˮ��Ӧ���������������백����Ӧ������������ɹ۲쵽����������
��ˣ�������ȷ���������Ĵ���Ӧ�Ƿ��ȷ�Ӧ���к���ɫ���������������������
(4)�����������Ư��������ʹƷ����ɫ�����л�ԭ�����������Ը�����ط���������ԭ��Ӧ��Ϊ��������������Ӧ��
��ˣ�������ȷ������Ũ��Һ �� ��ɫ����ԭ�ԡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Ԫ�ص�����������ȷ����(����)
A. ��Ԫ�����������Ԫ�� B. DNA����֬������PԪ��
C. �����е�NԪ�ش����ڼ���� D. �������е�NԪ����Ҫ�������ļ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������NH3D+�У�����������������������֮��Ϊ
A.10��7��11B.11��11��8C.10��11��8D.11��8��10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��X��Y��Z��W����Ԫ��ԭ�ӵĵ縺����ֵ�����ʾ��
Ԫ�� | X | Y | Z | W |
�縺�� | 2.5 | 4.0 | 1.2 | 2.4 |
��������Ԫ���У��������γɹ��ۼ�����( )
A.X��YB.X��WC.Y��ZD.Y��W
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������밢���ӵ�������ֵ( NA)�йص�˵����ȷ����
A. �ڱ�״���£�2.24Lˮ�к�����ԭ�ӵ���ĿΪ2NA
B. 8.0 g Cu2S��CuO�Ļ�����к���ͭԭ����Ϊ0.1NA
C. ���ܱ������м���0.5 mol N2��1.5 mol H2����ַ�Ӧ��ɵõ�NH3������ΪNA
D. 2.3 g Na��������ȫ��Ӧ����Ӧ��ת�Ƶĵ�������0.1NA��0.2NA֮��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ����������ȷ���ǣ�������
A. Fe��OH��3�����ж����ЧӦ��Fe��OH��3����������FeCl3��Һ��ʵ�����
B. ����峿������ʱ�γɵĹ������ǽ���Ķ����ЧӦ������
C. ��������Һ��������������Һ
D. ��FeCl3��Һ�м���NaOH��Һ������ֺ��ɫFe��OH��3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �� 1molFeCl3 ����Һ���ˮ���������������Ϊ 1NA
B. ��״���£�22.4LSO3 �����ķ�����Ϊ1NA
C. 1.0L0.1 mol��L1Na2CO3 ��Һ������������������ 0.1 NA
D. һ�������£�2.3gNa ��ȫ��O2��Ӧ���� 3.6g ����ʱʧȥ�ĵ�����Ϊ 0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮNa2SO3�������� 250 mL 0.1000 mol��L��1��Һ�IJ�������ͼ����ش�

��1�������ƹ����б�Ҫ�������У��ձ�������������ͷ�ιܡ���ƽ��____________��
��2�����в�������ʹ��õ�Na2SO3��ҺŨ��ƫ�͵���__________��
A������ƿ��������ˮϴ����û�к��
B��ͼ��û��������ˮϴ�ձ� 2-3 �Σ���ת��ϴҺ
C.ͼ��ʱ��������ƿ�Ŀ̶���
D.ͼ����Һ���Ե��ڿ̶��ߣ��ٵμ�����ˮʹҺ�氼����̶�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com