
【题目】下列说法正确的是
A. 含 1molFeCl3 的溶液充分水解产生胶体粒子数为 1NA
B. 标准状况下,22.4LSO3 所含的分子数为1NA
C. 1.0L0.1 mol·L1Na2CO3 溶液所含的阴离子数大于 0.1 NA
D. 一定条件下,2.3gNa 完全与O2反应生成 3.6g 产物时失去的电子数为 0.2NA
科目:高中化学 来源: 题型:
【题目】今有A、B、C三种元素,A、C元素原子的最外层电子数分别为6、2,B元素原子的最外层电子数是内层电子数的2倍,A原子比B原子多一个电子层,这三种元素分别为
A.Se Si BeB.O C MgC.O Si Ca D.S C He
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学课外活动小组利用以下装置完成系列实验.请回答以下问题:
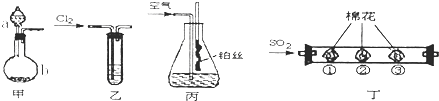
(1)装置甲中仪器a的名称为___ . 用装置甲制取NH3 , 在b中加入CaO固体,a中加入浓氨水,写出反应的化学方程式:___ .
(2)将C12持续通入装有淀粉一KI无色溶液的装置乙中,溶液变蓝而后逐渐褪色.查阅资料得知:溶液蓝色逐渐褪色,是因为有+5价的碘元素生成.请写出该反应的离子方程式:___ .
(3)用装置丙模拟“氨的催化氧化”实验.锥形瓶内装有浓氨水,通入空气,并将红热的铂丝插入锥形瓶内,铂丝保持红热.铂丝保持红热的原因是___;锥形瓶内还可观察到现象是___ .
(4)活动小组从“绿色化学”角度出发.在装置丁中进 行SO2的性质实验.其中棉花上蘸有不同试剂.请填写表中空白:
棉花位置 | ① | ② | ③ |
棉花上蘸有的试剂 | 品红溶液 | 酸性高锰酸钾溶液 | ___ |
现象 | ___ | 溶液紫色褪去 | 无 |
结论 | SO2具有漂白性 | SO2具有___ | SO2有毒,不能排空 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仔细分析下列表格中烃的排列规律,判断排列在第15位烃的分子式是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | … |
C2H2 | C2H4 | C2H6 | C3H4 | C3H6 | C3H8 | C4H6 | C4H8 | C4H10 |
A.C6H14B.C6H12C.C7H12D.C7H14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种甜味剂A的甜度是蔗糖的200倍,由于它热值低、口感好、副作用小,已在90多个国家广泛使用。A的结构简式为:

已知:①在一定条件下,羧酸酯或羧酸与含—NH2的化合物反应可以生成酰胺,如:

②酯比酰胺容易水解。
![]()
请填写下列空白:
(l)在稀酸条件下加热,化合物A首先生成的水解产物是:________和______。
(2)在较浓酸和长时间加热条件下,化合物A可以水解生成:______________、________________和__________________。
(3)化合物A分子内的官能团之间也可以发生反应,再生成一个酰胺键,产物是甲醇和__________________________。(填写结构简式,该分子中除苯环以外,还含有一个6原子组成的环)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生反应 2CH3OH(g)![]() CH3OCH3( g)+H2O(g)
CH3OCH3( g)+H2O(g)
容器 | 温度(℃) | 起始物质的量(mmol) | 平衡物质的量 (mol) | |
编号 | ||||
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.10 | 0.040 | 0.040 |
Ⅱ | 387 | 0.20 | ||
Ⅲ | 207 | 0.20 | 0.090 | .090 |
则下列说法正确的是
A. 该反应的H﹥0
B. 达到平衡时,CH3OH 体积分数容器Ⅱ中的比容器 I 中的大
C. 反应达到平衡所需时间容器Ⅱ比容器Ⅲ长
D. 207℃ 若向容器Ⅳ( 1.0L 恒容密闭)充入 CH3OH 0.1mol、CH3OCH3 0.15mol 和 H2O0.20mol, 则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以工业生产硼砂所得废渣硼镁泥(主要含 MgO、SiO2、Fe2O3,另含少量 FeO、CaO、 Al2O3 、B2O3 等)为原料制取 MgSO4·7H2O 的工艺流程如下:

回答下列问题:
(1)过滤需用到的玻璃仪器有玻璃棒、烧杯和_______;其中玻璃棒的作用是___________。
(2)滤渣 1 中的某种物质 是玻璃的主要成分之一,玻璃另外两种主要成分的化学式为_____________。除杂过程加入MgO 的作用是__________________。
(3)写出除杂过程中次氯酸钙将 Fe2+氧化的离子方程式__________________。
(4)除杂过程中,当 c(Al3+)=1×105 mol/L 时,c(Fe 3+)=__________mol/L。(已知Ksp [Al(OH)3] = 3.2×1034 , Ksp[Fe(OH)3]= 1.1×1036,结果保留两位有效数字 )
(5)滤渣 3 主要成分的化学式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
A. 0.5molH2O所含的电子数为5NA
B. 1molNH4+所含质子数为10NA
C. 标准状况下,22.4LCO2所含的共价键数目为4NA
D. 常温常压下,32gO2和O3的混合气体所含氧原子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com