
科目: 来源: 题型:
【题目】已知自然界氧的同位素有16O , 17O ,18O,若氢的同位素有H、D、T,从水分子的原子组成来看,自然界的水一共有几种
A.18种B.6种C.9种D.12种
查看答案和解析>>
科目: 来源: 题型:
【题目】用Pb电极电解含有Cu2+和X3+均为0.1mol的溶液,阴极析出金属的质量m与溶液中通过电子的物质的量n关系如图,则离子的氧化性能力由大到小排列正确的是( )

A. Cu2+>X3+>H+ B. H+>X3+>Cu2+
C. X3+>H+>Cu2+ D. Cu2+>H+>X3+
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下在容积不变的密闭容器中,进行如下可逆反应:H2(g)+CO2(g)![]() CO(g)+H2O(g),下列能表明该反应已达到平衡状态的是 ( )
CO(g)+H2O(g),下列能表明该反应已达到平衡状态的是 ( )
A. 混合气体的密度保持不变
B. 容器中的压强保持不变
C. υ正(CO2)=υ逆(CO)
D. CO、H2O的物质的量浓度之比不变时
查看答案和解析>>
科目: 来源: 题型:
【题目】反应NH4HS(s)![]() NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是( )
NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是( )
A. 温度、容积不变时,通入SO2气体 B. 移走一部分NH4HS固体
C. 将容器体积缩小为原来的一半 D. 保持压强不变,充入氮气
查看答案和解析>>
科目: 来源: 题型:
【题目】以下各组物质在发生相应变化时所克服的微粒间作用力完全相同的是( )
A. 干冰升华和液溴挥发
B. 金刚石熔化和硫磺(S8)熔化
C. 硝酸钾溶于水和H2SO4溶于水
D. KHSO4熔融和HI分解
查看答案和解析>>
科目: 来源: 题型:
【题目】NH3是一种重要的化工原料,可以制备一系列物质(见下图),下列说法正确的是( )

A. NH4Cl和NaHCO3都是常用的化肥
B. NH4Cl、HNO3和Na2CO3受热时都易分解
C. NH3和NO2在一定条件下可发生氧化还原反应
D. 图中所涉及的盐类物质均可与Ca(OH)2发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如下图所示,下列说法不正确的是

A. 该电池在高温下工作的速度更快
B. HS-在硫氧化菌作用下转化为SO42-的反应是:HS-+4H2O-8e-= SO42-+9H+
C. b是电池的负极
D. 若该电池有0.45 mol 电子转移,则有0.45 mol H+向左通过质子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关原子结构的说法,正确的是( )
A. 决定元素种类的是—电子数
B. 决定元素化学性质的是—原子的核外电子数
C. 决定元素相对原子质量的是—中子数
D. 决定元素周期表中原子序数的是—核电荷数
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:______________________________。

(2)一定温度下,向2L恒容密闭容器中充入4.0mol NO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H<0,测得相关数据如下:
N2(g)+4CO2(g) △H<0,测得相关数据如下:
①0~5min,用NO2的浓度变化表示的反应速率为____。
②以下表述能说明该反应己达到平衡状态的是____。
A.气体颜色不再变化 B.气体密度不再变化 C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,在t1时反应再次达到平衡,则NO2的转化率比原平衡____(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= _____。
(3)湿法脱硝:采用NaClO2 溶液作为吸收剂可对烟气进行脱硝。323 K 下,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,溶液中离子浓度的分析结果如下表:
离子 | NO3- | NO2- | Cl- |
c/(mol L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
①NaClO2 溶液显碱性,用离子方程式解释原因_______________________。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素X、Q、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,Q和Y在周期表中的位置相邻,请回答下列问题:
(1)写出单质R的一种工业用途_______________________。
(2)M和R的最高价氧化物的水化物中酸性最强的是___________(用化学式表示)。
(3)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,写出该转化过程的化学方程式为____________________。
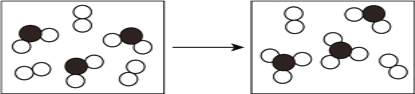
(4)由X、Y、Z、M四种元素组成的一种离子化合物A,已知A,既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式___________。
(5)科学家认为存在QX5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,已知QX5中含有离子键和极性键,写出化合物的电子式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com