
科目: 来源: 题型:
【题目】铁、铝是重要的金属材料,铁、铝及其化合物有非常重要的用途。
(1)下列说法正确的是________(填序号)。
① 配制氯化铁溶液,先将FeCl3固体溶于较浓盐酸,再用蒸馏水稀释到所需的浓度
② FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
③ 利用氯水和KSCN溶液可以检验Fe3+中有无Fe2+
④ 加热蒸干Fe2(SO4)3溶液获得Fe2(SO4)3固体
⑤ 含a mol AlCl3的溶液和含1.5a mol NaOH的溶液,无论正滴和反滴,生成Al(OH) 3的质量相等
⑥ 由于金属铝性质稳定,所以Al在空气中能稳定存在
(2)高铁酸钾(K2FeO4)是一种高效多功能水处理剂。其作用原理为__________________。
(3)以铝土矿(主要成分为Al2O3和Fe2O3、SiO2)为原料制备铝的一种工艺流程如下:
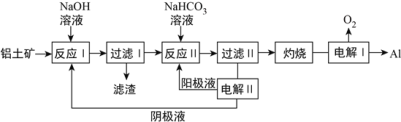
①滤渣主要成分为___________________
②在实验室灼烧操作应选择的实验仪器为_____________________
③反应II中,加入NaHCO3一段时间才有沉淀生成,写出加入少量NaHCO3时发生反应的离子方程式________。
(4)已知25 ℃时Ksp[Cu(OH)2]=2.2×1020,Ksp[Fe(OH)3]=4.0×1038, Ksp[Al(OH)3]=1.1×1033。
①在25 ℃下,向浓度均为0.1 mol·L1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×105 mol·L1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是

A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,某一元弱酸HA的电离常数K=1.6×10-6。 向20.00 mL 浓度约为0.1 mol·L-1 HA溶液中逐滴加入0.1000 mol·L-1 的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:(已知lg4=0.6)
(1)a点溶液中pH约为________,此时溶液中H2O电离出的c(H+)为________。

(2)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用__________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(3)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_________________(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(4)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_____mol/L。
实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知CH3COONH4溶液呈中性,又知CH3COOH溶液加到NaHCO3溶液中有气体放出,试推断常温下NH4HCO3溶液的pH______7(填“>”、“<”或“=”)。
(2)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。
(3)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
(4)电化学法是合成氨的一种新方法,其原理如图所示,阴极的电极反应式是_____。

查看答案和解析>>
科目: 来源: 题型:
【题目】已知气态烃A的密度是相同状况下氢气密度的14倍,有机物A-E能发生下图所示一系列变化,则下列说法错误的是( )
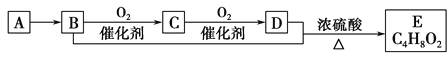
A. A分子中所有原子均在同一平面内
B. C4H8O2含酯基的同分异构体有6种
C. D可与Na2CO3溶液反应
D. 等物质的量的B、D与足量钠反应生成气体的量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】胰蛋白酶作用于一定量的某种物质(底物),温度保持37 ℃,pH保持在最适值,生成物量与反应时间关系如下图。请回答下列问题。
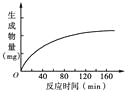
(1)该酶作用的底物是 。
(2)在140 min后,曲线变成水平,这是因为
________________________________________________________________________。
(3)若增加胰蛋白酶浓度,其他条件不变,请在原图上画出生成物量变化的示意曲线。
(4)若胰蛋白酶浓度和其他条件不变,反应液pH由2逐渐升高到10,则酶催化反应的速率将________,原因是____________________________________。
(5)下图中能正确表示胰蛋白酶对底物的分解速率和温度关系的是( )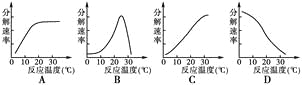
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2- 三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是
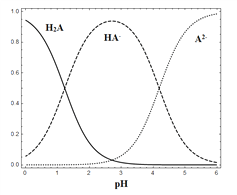
A. 在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,α(HA-)一定增大
B. 将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)
C. NaHA溶液中,HA-的水解能力小于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA-)一定相等
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 0.5 mol Al与足量盐酸反应转移电子数为NA
B. 标准状况下,22.4 L氨气与22.4 L氮气所含原子数均为2NA
C. 58.5 g NaCl所含的离子数为2NA
D. 硫酸根离子的摩尔质量是98 g·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】取3.40g只含羟基,不含其它官能团的液态饱和多元醇,置于5.00L氧气(过量)中,经点燃,醇完全燃烧。反应后气体体积减少0.56L。将气体经CaO吸收,体积又减少2.80L(所有体积均在标准状况下测定)。
(1)3.40g醇中C、H、O的物质的量分别为: C____mol.H_____mol.O_______mol;该醇中C、H、O的原子个数之比为___________。
(2)由以上比值能否确定该醇的分子式______;其原因是:____________。
(3)如果将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,试写出该饱和多元醇的结构简式___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】山梨酸是目前国际上公认的安全防腐剂。山梨酸可由山梨醛经如下过程合成:
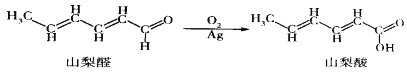
下列有关说法正确的是( )
A. 山梨酸与CH2=CH-COOH互为同系物
B. 山梨醛能发生取代、氧化、还原和加成反应
C. 与山梨酸含有相同官能团且含一个五元环的山梨酸的同分异构体有5种
D. 山梨酸分子中处于同一平面的原子最多13个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com