
科目: 来源: 题型:
【题目】用50mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)观察实验装置,图中尚缺少的一种玻璃用品是__________。
(2)烧杯间填满碎纸条的作用是_________________________。
(3)大烧杯上口不盖硬纸板,测得的中和热数值 __________(填“偏大、偏小、无影响”)。
(4)实验中改用55mL 0.50 mol/L盐酸与55mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量__________ (填“相等、不相等”),所求中和热__________ (填“相等、不相等”)。
(5)在中和热测定实验中,若用相同浓度和体积的氨水代替NaOH溶液进行实验,测得的中和热的数值会____(填“偏大”、“偏小”“不变”)原因是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
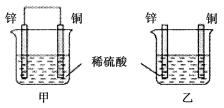
①两烧杯中铜片表面均无气泡产生
②甲中铜片是正极,乙中铜片是负极
③两烧杯中溶液的c(H+)均减小
④产生气泡的速率甲比乙慢
⑤甲中SO42-向Zn片移动,H+向Cu片移动
⑥乙中电流从Cu片流向Zn片
⑦甲乙两烧杯中Cu片的质量均不变
A. ①②③B. ③⑤⑦
C. ④⑤⑥D. ②③④⑤⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中能大量共存的离子组是( )
A.I- Cl- ClO- Na+B.H+ Fe2+ NO3- MnO4-
C.K+ Ba2+ OH- NO3-D.S2- SO32- Na+ H+
查看答案和解析>>
科目: 来源: 题型:
【题目】在某无色透明酸性溶液,能够共存的离子组是( )
A.Al3+、NH4+、NO3﹣、Cl﹣B.Br﹣、Fe2+、Fe3+、SO42﹣
C.Na+、SO32﹣、K+、NO3﹣D.K+、Na+、I ﹣、CO32﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.胶体区别于其他分散系的根本原因是胶体有丁达尔效应
B.分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液
C.向氢氧化钠溶液中边滴加饱和FeCl3溶液边振荡制备Fe(OH)3胶体
D.胶体的分散质可以通过过滤从分散剂中分离出来
查看答案和解析>>
科目: 来源: 题型:
【题目】关于Li、Na、K、Rb、Cs的叙述均正确的一组是( )
①金属性最强的是铯 ②它们的氧化物都只有M20和M202两种形式
③在自然界中均以化合态形式存在 ④密度按Li→Cs 顺序依次递增
⑤离子半径:Rb+>K+>Na+
A.①②③B.③④⑤C.②④⑤D.①③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3、CO等物质。研究脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点,对于消除环境污染有重要意义。
(1)已知催化剂存在的条件下H2可以将NO还原为N2。下图是一定条件下H2还原NO生成N2和1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式__________________ 。(ΔH用E1、E2、E3表示)

(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)2NO2(g)的反应历程分两步:
I.2NO(g)N2O2(g)(快); v1正=k1正.c2(NO); v1逆=k1逆.c(N2O2) △H1<0
II.N2O2(g)+O2(g)2NO2(g)(慢); v2正=k2正.c(N2O2)c(O2); v2逆=k2逆.c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=__________________。
②决定2NO(g)+O2(g)2NO2(g)速率的是反应 II,反应 I的活化能E1与反应 II的活化能E2的大小关系为E1___E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是___。
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
③由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为____(填字母)。

(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

已知甲池中发生的反应为:
①装置中H+从__________ 移向__________(填“甲池”或“乙池”)。
②乙池溶液中发生的反应为______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是( )。
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是( )。

A. 温度:T1>T2>T3
B. 正反应速率:v(b)>v(d) v(a)>v(c)
C. 平衡常数:K(a)>K(c) K(b)=K(d)
D. 平均摩尔质量:M(b)>M(d) M(a)<M(c)
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应2X(g) + Y(g) ![]() 3Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
3Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
(1)升高温度:____________;
(2)增大压强:____________;
(3)增大容器容积:______________;
(4)加入 X :______________;
(5)加入 Y :______________;
(6)压缩体积:______________;
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)反应2NO2(g) ![]() N2O4(g) ΔH<0;在温度为T1、T2时,平衡体系中NO2的体积分数随体系压强变化曲线如图所示。下列说法错误的是( )
N2O4(g) ΔH<0;在温度为T1、T2时,平衡体系中NO2的体积分数随体系压强变化曲线如图所示。下列说法错误的是( )

A. T2 > T1,P2 > P1 B. B、C两点的反应速率:B > C
C. A点的气体颜色比B点的深 D. A、C两点气体的平均相对分子质量:A < C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com