
科目: 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。


据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目: 来源: 题型:
【题目】钒(23V)被称为“现代工业味精”,可添加在钢铁中,并以钛-铝-钒合金的形式用于航天领域;钒的化合物被广泛用作催化剂、燃料及电池等。我国钒钛磁铁矿储量较大,是世界上产钒大国。请完成下列问题:
(1)钒的基态原子的外围电子排布式为_____。
(2)钒的某种氧化物的晶胞结构如下图1所示,则该氧化物的化学式为________,其熔沸点比下图3(为邻苯二甲酸酐的结构)物质的熔沸点要________(填“高”、“低”或“差不多”)。
(3)V2O5是一种常见的催化剂,在合成硫酸、硝酸、邻苯二甲酸酐、乙烯、丙烯中,均使用五氧化二钒作催化剂。

①五氧化二钒的结构简式如上图2所示,则该结构中含有_______个π键。
②在丙烯(CH3CH=CH2)分子中碳原子的杂化方式分别为__________。
③H、C、N、O四元素,其电负性从大到小的顺序依次为___________________。
④V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。列举与![]() 空间构型相同的一种阳离子:________(填离子符号)。
空间构型相同的一种阳离子:________(填离子符号)。
(4)已知单质钒的晶胞如上图5所示,假设晶胞的边长为d×10—7cm,钒的相对原子质量为M,则密度为__________g·cm-3。(设阿伏加德罗常数为NA)
查看答案和解析>>
科目: 来源: 题型:
【题目】有机化合物甲有镇咳、镇静的功效,其合成路线如下:
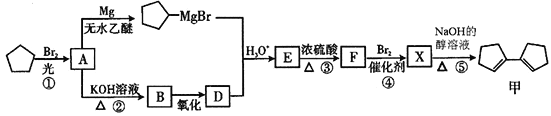
已知: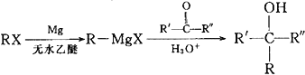 (R、R'、R"代表烃基或氢)
(R、R'、R"代表烃基或氢)
(1)有机物甲的分子式为___________,有机物A中含有的官能团的名称为_______________。
(2)有机物B的名称是__________,由B→D 所需的反应试剂和反应条件为________________。
(3)在上述①~⑤反应中,属于取代反应的有____________(填序号)。
(4)写出E→F的化学方程式________________。
(5)满足“属于芳香族化合物”的甲的同分异构体有________种。其中核磁共振氢谱上只有2组峰的结构简式是______________
(6)根据题给信息,写出以CH4为原料制备CH3CHO的合成路线(其他试剂任选)__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学购买了一瓶“84消毒液”,包装说明如下,请根据以上信息和相关知识判断,下列分析不正确的是

A. 该“84消毒液”的物质的量浓度约为4.0 mol·L-1
B. 一瓶该“84消毒液”敞口放置一段时间后浓度会变小
C. 取100 mL该“84消毒液”稀释100倍,稀释后溶液中c(Na+)约为0.04mol·L-1
D. 参阅该“84消毒液”的配方,欲用NaClO固体配制含25%NaClO的消毒液480mL,需要称量的NaClO固体质量为143g
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钠是______________色固体,与CO2反应的化学方程式_________________________________________.因此,过氧化钠可作为呼吸面具和潜水艇的氧气来源.
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
A. ΔH1>0,ΔH3<0B. ΔH2>0,ΔH4>0C. ΔH1=ΔH2+ΔH3D. ΔH3=ΔH4+ΔH5
查看答案和解析>>
科目: 来源: 题型:
【题目】在强酸性溶液中能大量共存且溶液为无色透明的离子组是
A.Ag+、NO3–、Cl–B.Na+、Fe3+、NO3–
C.K+、Cl–、HCO3–D.Mg2+、Cl–、SO42–
查看答案和解析>>
科目: 来源: 题型:
【题目】氮元素有多种氧化物。请回答下列问题:
(1)已知:H2的燃烧热ΔH为-285.8kJ·mol-1。
N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol-1
H2O(g)=H2O(1) ΔH=-44kJ·mol-1
则4H2(g) + 2NO2(g) = 4H2O(g) + N2(g) ΔH=__________。
(2)一定温度下,向2L恒容密闭容器中充入0.40mol N2O4,发生反应:N2O4(g)![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol·L-1) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①0-40s内,v(NO2)=________mol·L-1·s-1。
②升高温度时,气体颜色加深,则上述反应是________(填“放热”或“吸热”)反应。
③该温度下反应的化学平衡常数K=________mol·L-1。
④相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后c(NO2)________ (填“>”“=”或“<”)0.60mol·L-1。
(3)N2O5是绿色硝化试剂,溶于水可得硝酸。下图是以N2O4为原料电解制备N2O5的装置。写出阳极区生成N2O5的电极反应式(注意阳极区为无水环境,HNO3亦无法电离):________________________。

(4)湿法吸收工业尾气中的NO2,常选用烧碱溶液,产物为两种常见的含氧酸盐。该反应的离子方程式是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,作为信息产业和机电工业的重要基础功能材料,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:

已知:几种金属离子沉淀的pH如下表。
Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.2 | 3.7 | 7.8 | 10. 4 |
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有________。
A.搅拌 B.适当升高温度 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的金属阳离子为Fe3+、Mn2+,浸取后的溶液中含有少量Fe2+、Cu2+、Ca2+,则在加入石灰调节溶液的pH从而使铁元素被完全沉淀前,加入适量的软锰矿,其发生反应的离子方程式为____________________,加入石灰调节溶液pH的范围为____________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是________(填化学式)和CaF2。若测得滤液中c(F-)为0.01mol·L-1,则滤液中残留c(Ca2+)为________mol·L-1[已知:Ksp(CaF2)=1.46×10-10]。
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是______________________________________。
(5)下图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在________%左右。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com