
科目: 来源: 题型:
【题目】铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2`12H2O]的工艺流程如图所示:

请回答下列问题:
(1)固体a的化学式为_________,Ⅲ中反应的离子方程式为___________________________。
(2)Ⅴ中反应的化学方程式为__________________________。从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)___________、冷却结晶、过滤洗涤干燥等。
(3)以1000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g·cm-1)___________L(保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘海醇为非离子型造影剂,适用于有造影剂反应的高危因素的病人。下面是以化合物A为原料合成碘海醇的路线:
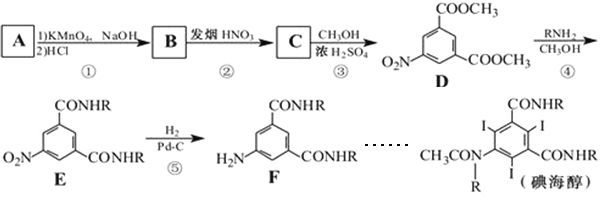
其中R-为-CH2CH(OH)CH2OH
请回答以下问题:
(1)物质D中含有的官能团为________。
(2)A是苯的同系物,相对分子量为106,则A的结构简式是_______________。
(3)写出A的侧链与氯气发生一氯取代的条件_____________。
(4)反应②的化学方程式______________。
(5)反应①→⑤中,属于氧化反应的是_____________(填序号)。
(6)写出能同时满足下列条件的D的两种同分异构体的结构简式:_________。
Ⅰ.苯环上有3个取代基,苯环上的一卤代物有2种;
Ⅱ.能发生银镜反应,水解产物之一能与FeCl3溶液发生显色反应;
Ⅲ.含有1个α-氨基酸的结构(例如:CH3CH(NH2)COOH属于α-氨基酸)
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组提纯粗金(主要含Au,还含少量Ag)的实验流程如下:

已知:① 浓硝酸和浓盐酸的混合物(体积比为1:3)叫做王水。
② 利用H2C2O4还原H[AuCl4]可得到Au。
(1)“溶解”前,先将粗金块切割成细条状,其目的是_____________________________________。“溶解”时Au转化为H[AuCl4],该反应的化学方程式为_____________________________。
(2)“滤渣”的主要成分为____________________(填化学式)。
(3)“操作Ⅰ”的名称为_____________________。
(4)“操作Ⅱ”需控制在40~70℃时进行,适宜的加热方式为___________________________。
(5)请设计从“操作Ⅱ”后的水溶液中获取单质Au的实验方案:___________。(实验中须使用的试剂有:H2C2O4溶液,蒸馏水;除常用仪器外须使用的仪器有:布氏漏斗)。
查看答案和解析>>
科目: 来源: 题型:
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)![]() HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
3HNO2(aq)![]() HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
反应3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____________________________________。
(3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:____________________________________。
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为__________mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见题20图1)。

反应相同时间NOx的去除率随反应温度的变化曲线如题20图2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,一般情况下X的单质只有氧化性:
(1)写出实验室制取W2反应的离子方程式:________________________。
(2)某小组设计如图所示的实验装置(图中夹持和加热装置略去),分别研究YX2、W2的性质。
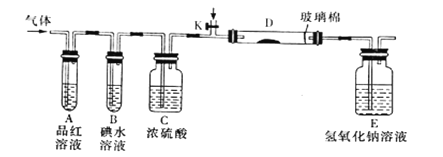
①分别通入YX2和W2,在装置A中观察到的现象是否相同_________________(填“相同”、“不相同”);若装置D中装的是铁粉,当通入W2时D中观察到的现象为__________;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学方程式为_______________________________________。
②若装置B中装入5.0mL1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为__________________。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量_____(填字母)可以看到白色沉淀生成。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(4)如由元素Y和X组成-2价酸根Z,Z中Y和X的质量比为Y:X=4:3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入足量氯化钡溶液,有白色沉淀产生,且两种沉淀物质量相等。写出W2与Z的溶液完全反应产生浅黄色沉淀的离子方程式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质的转化关系如图所示。A是生活中常用的调味品,B是常见的无色液体。气体C是空气的主要成分之一,I的溶液常用作漂白剂。气体H的水溶液显碱性。J的摩尔质量是32g·mol-1,且与H所含元素种类相同。

回答下列问题:
(1)C的结构式是_____,I的化学式是_____。
(2)反应①的离子方程式是______。
(3)反应②的化学方程式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)甲醇是一种可再生能源,用途广泛,一种由甲醇、氧气以及强碱溶液制成的新型手机电池,容量达氢镍电池或锂电池的10倍。回答下列有关问题:
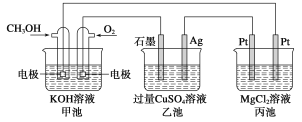
如图所示:
①甲池通入CH3OH的电极反应式为__________;乙池石墨一极的电极反应式为______;
②反应一段时间后,向乙池中加入一定量________能使CuSO4溶液恢复到原浓度;
③甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生__________g沉淀。
(2)工业上有一种生产甲醇的反应:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1。在某温度下,容积均为2L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1。在某温度下,容积均为2L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
容器 | A | B |
反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
CH3OH(g)浓度(molL-1) | c1 | c2 |
反应能量变化 | 放出29.4kJ | 吸收akJ |
①从反应开始至达到平衡时,A中用CO2来表示的平均反应速率为______________;
②该温度下,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的化学平衡常数的值为_____________;
CH3OH(g)+H2O(g)的化学平衡常数的值为_____________;
③a=______________。
④下列措施中能使n(CH3OH)/n(CO2)增大的是____________。
A.升高温度 B.充入氢气
C.将水蒸气从体系中分离 D.用更有效的催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是( )
A.硅胶可用作催化剂的载体和袋装食品的干燥剂
B.合金中至少含有两种金属元素
C.Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
D.硅以单质形式存在于地壳中
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W是原子序数依次递增的短周期主族元素。Y、W同主族,且W的核电荷数是Y的2倍,X、Y、W三种元素原子的最外层电子数之和为17,Y与Z可形成离子化合物Z2Y和Z2Y2。
(1)Y在元素周期表中的位置为____。Z的最高价氧化物的水化物的电子式是______,存在的化学键的类型为_______。
(2)Y、Z、W的原子半径从大到小的顺序是______(用元素符号表示)。X的简单气态氢化物和W最高价氧化物的水化物反应的离子方程式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。

已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于__________________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com