
科目: 来源: 题型:
【题目】汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、氮氧化物吸收,原理如下图所示。
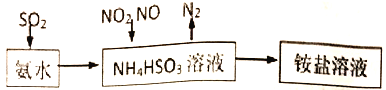
①25℃时,在pH=5的 NH4HSO3溶液中,c(SO32-)+c(NH3·H2O)-c(H2SO3)=__________mol/L(填确值)
②请写出NO2和NO按体积比1:1被吸收时反应的离子方程式_____________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ·mol-1
3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ·mol-1
TiO2催化尾气降解原理可表示为:2COg)+O2(g)![]() 2CO2(g) △H3
2CO2(g) △H3
则2H2O(g)+4NO(g)+3O2(g)![]() 4HNO3(g) △H4=______________________。
4HNO3(g) △H4=______________________。
②在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图1所示。请解释T1后NO降解率下降的可能原因______________________。
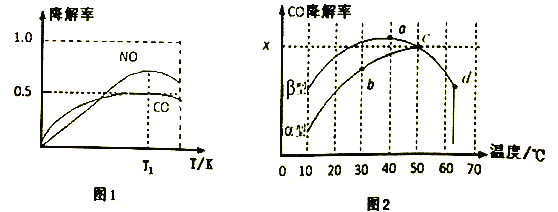
(3)沥青混凝土也可降解CO。如图2为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L-1,求此温度下CO降解反应的平衡常数____________________________________________。(用含x的代数式表示)
②科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“![]() ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。____________
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。____________
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列因果关系不正确的是( )
选项 | 原因 | 结果 |
A | 大量植树造林 | 温室效应 |
B | SO2和NO2气体的大量排放 | 酸雨 |
C | 含氮、磷等生活废水的大量排放 | 水华、赤潮 |
D | 汽车尾气的大量排放 | 光化学烟雾 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】某酸的酸式盐NaHY的水溶液中,HY-的电离程度小于HY-的水解程度,有关叙述中正确的是
A. H2Y在电离时为:H2Y+H2O ![]() HY-+H3O+
HY-+H3O+
B. 在该盐的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C. 在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(Y2-)>c(OH-)>c(H+)
D. HY-的水解方程式为:HY-+H2O ![]() H3O++Y2-
H3O++Y2-
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵晶体在500°C时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵晶体隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和__________________
(2)为检验分解产物的成分,设计如下实脸装置进行实验,加热A中的硫酸亚铁铵晶体至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是_______________________________。
②为检验A中残留物是否含有FeO,需要选用的试剂有______________(填标号)。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
(3)通入酸性高锰酸钾溶液,溶液褪色,该反应中SO2表现出化学性质是_____
查看答案和解析>>
科目: 来源: 题型:
【题目】有研究人员设计了如下利用含硫物质热化学循环实现太阳能的转化与存储的过程.

回答下列问题:
(1)反应I中,主要能量转化形式为__________能转化为_____________能。
(2)S在元素周期表中位于第___________周期第_____________族。
(3)下列事实中,能说明硫的非金属性比碳强的是__________________(填标号)。
A.H2SO3的酸性比H2CO3的酸性强
B.在硫与碳的化合物CS2中S显负价
C.硫的单质的硬度比金刚石低
(4)配平反应Ⅱ的化学方程式:________SO2+_________H2O=______H2SO4+______S,该反应中氧化剂是_______________。
(5)通过反应Ⅲ也可以不经过热能转化过程而直接获取电能,化学上将实现这一直接转化的装置称为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯硝酸锶[Sr(NO3)2]可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
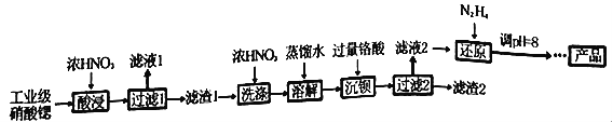
已知:①“滤液1”的主要溶质是Ca(NO3)2;“滤渣1”的成分为Ba(NO3)2、Sr(NO3)2;“滤渣2”的主要成分为 BaCrO4(杂质不与硝酸反应)。②铬酸(H2CrO4)为弱酸。
(1)“酸浸”不能采用高温的原因是_________________________________。
(2)相对于水洗,用浓HNO3洗涤的优点是_________________________________。
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出反应的离子方程式_______________________________________________________。
(4)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全?______________________(列式计算)。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全?______________________(列式计算)。
(5)已知Cr(OH)3类似Al(OH)3,还原后溶液的pH不能大于8的原因是:___________。(结合离子方程式说明理由)。
(6)为了测定“滤渣2”中 BaCrO4的含量,进行以下实验:
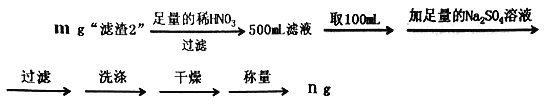
①判断Ba2+完全沉淀的方法:____________________________________________。
②“滤渣2”中BaCO4的质量分数为______________________(用代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)![]() PCl5(g) △H<0,有关数据如下:
PCl5(g) △H<0,有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度(mol/L) | c1 | c2 | 0.4 |
下列判断不正确的是
A. 10 min内,v(Cl2)=0.04 mol/(Lmin)
B. 当容器中Cl2为1.2 mol时,反应达到平衡
C. 升高温度,反应的平衡常数增大,平衡时PCl3的物质的量浓度<1.6mol/L
D. 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的溶解平衡曲线。下列有关说法正确的是

A. CaCO3(s)![]() Ca2+(aq)+ CO32-(aq) ΔH<0
Ca2+(aq)+ CO32-(aq) ΔH<0
B. a、b、c、d四点对应的溶度积Ksp相等
C. 温度不变,蒸发水,可使溶液由a点变到c点
D. 25 ℃时,CaCO3的Ksp=2.8×10-9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com