
科目: 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A.4g固体硫完全燃烧生成SO2,放出37 kJ热量:S(s)+O2(g)=SO2(g) ΔH= -296kJ/mol
B.1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-73kJ/mol
2NH3(g) △H=-73kJ/mol
C.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+ 2H2O(g) △H=-890.3kJ·mol-1
D.强酸强碱的中和热为-57.3 kJ/mol: Ba(OH)2(aq)+H2SO4(aq)=BaSO4(S)+2H2O(l) △H=-114.6kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数/ mol/ L | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列说法正确的是
A. 等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
B. 将等浓度的 HA溶液与NaA溶液等体积混合,混合液中:c(A-)<c(Na+)
C. 向 Na2B溶液中加入足量的 HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D. NaHB溶液中部分微粒浓度的关系为:c(Na+)=c(HB-) +c(H2B)+c(B2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
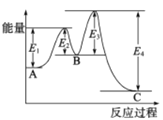
A. △H= E4- E3+E2-E1
B. 加入V2O5后反应经过两步完成,其中第一步决定反应速率
C. 加入V2O5,△H不变,但反应速率改变
D. 向密闭容器中充入2molSO2和1molO2,发生上述反应达平衡时,反应放热198kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化:

该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
(1)已知:t1温度下,![]() ,
,![]() ,该温度下反应的平衡常数值K1=_____;该反应的活化能Ea(正)小于Ea(逆),则
,该温度下反应的平衡常数值K1=_____;该反应的活化能Ea(正)小于Ea(逆),则![]() ________0(填“小于”“等于”或“大于”)。
________0(填“小于”“等于”或“大于”)。
(2)t2温度下,图中能表示顺式异构体的质量分数随时间变化的曲线是_______(填曲线编号),平衡常数值K2=_____;温度t2___t1(填“小于”“等于”或“大于”),判断理由是______。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列各项属于油脂的用途的是( )
①作人类的营养物质 ②制取甘油 ③制取肥皂 ④制备高级脂肪酸 ⑤制备矿物油
A.仅①②③④B.仅①③⑤CC.仅①②④⑤D.仅①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是 ( )

A.通电后中间隔室的SO42-向阳极迁移,阳极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.阴极反应为4OH--4e-=O2↑+2H2O,阴极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有11.2L O2生成(标况)
查看答案和解析>>
科目: 来源: 题型:
【题目】红矾钠(Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:
4FeO(s)+4Cr2O3(s)+8Na2CO3(s)+7O2(g) ![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)如图为上述反应的浓度—时间图像,由图像判断反应进行至t2时刻时,改变的条件是_________________________,如图为上述反应的速率—时间图像,表示上述反应在t1时达到平衡, 在t2时因改变某个条件而使曲线发生变化。由图判断,t2时刻曲线变化的原因可能是________(填写序号)。
a.升高温度 b.加催化剂
c.通入O2 d.缩小容器体积

(2)工业上可利用上述反应的副产物CO2来生产甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①一定温度下,在容积为1L的密闭容器中,充入2 mol CO2和4 mol H2,一段时间后达到平衡,测得CH3OH的物质的量浓度为1mol/L,则该温度下此反应的平衡常数为_________,某时刻测得CO2、H2、CH3OH和H2O的物质的量分别为2mol,1mol,1mol,1mol,则这一时刻v(正)___________v(逆)
②在T1温度时,将1 mol CO2和3 mol H2充入一密闭容器中,充分反应达到平衡后,CO2转化率为α,则容器内的压强与起始压强之比为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可以由石英与焦炭在高温下的氮气流中,通过以下反应制得:3SiO2(s) + 6C(s) +2N2(g)![]() Si3N4(s) +6CO(g)
Si3N4(s) +6CO(g)
(1)该反应的平衡常数表达式为K=___________________;
(2)不同温度下SiO2的平衡转化率随时间的变化如图所示,则该反应为___________反应(填“吸热”或“放热”);升高温度,其平衡常数值将___________(填“增大”“ 减小”或“不变”);
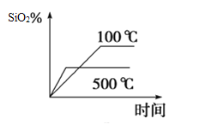
(3)已知反应达到平衡时,CO的生成速率为v (CO) =18 mol·L-1·min-1,则N2消耗速率为v(N2)=
____________mol·L-1·min-1。
(4)反应达到平衡时,压缩容器的体积,平衡将向________反应方向移动(填“正”或“逆”);
查看答案和解析>>
科目: 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( )

A. 燃料电池工作时,正极反应为:O2+ 2H2O + 4e-= 4OH-
B. 若a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. 若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
D. 若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com