
����Ŀ����֪25��ʱ�й�����ĵ���ƽ�ⳣ�����±�:
���ữѧʽ | HA | H2B |
����ƽ�ⳣ��/ mol/ L | Ka=1.7��10-6 | Ka1=1.3��10-3 Ka2=5.6��10-8 |
������˵����ȷ����
A. �����ʵ���Ũ�ȵĸ���ҺpH��ϵΪ��pH(Na2B)>pH(NaHB)>pH(NaA)
B. ����Ũ�ȵ� HA��Һ��NaA��Һ�������ϣ����Һ�У�c(A-)<c(Na+)
C. �� Na2B��Һ�м��������� HA��Һ������Ӧ�����ӷ���ʽΪ��B2-+2HA=2A-+H2B
D. NaHB��Һ�в�����Ũ�ȵĹ�ϵΪ��c(Na+)=c(HB-) +c(H2B)+c(B2-)
���𰸡�D
��������
���볣��Խ������Խǿ���ɱ������ݿ�֪���ԣ�����H2B��HA��HB-����ѧ��ӦӦ������ǿ�������ص㣬HA�ĵ��볣��Ϊ1.7��10-6����A-��ˮ�ⳣ��Ϊ![]() ���ݴ˽��
���ݴ˽��
A������H2B��HA��HB-������Խǿ����Ӧ�����εļ���Խ����A����
B.HA�ĵ��볣��Ϊ1.7��10-6����A-��ˮ�ⳣ��Ϊ![]() ����֪HA�ĵ��볣������A-��ˮ�ⳣ��������Ũ�ȵ� HA��Һ��NaA��Һ����������Һ�����ԣ�HA�������ô���A-ˮ�����ã�����c(A-)>c(Na+)��B����
����֪HA�ĵ��볣������A-��ˮ�ⳣ��������Ũ�ȵ� HA��Һ��NaA��Һ����������Һ�����ԣ�HA�������ô���A-ˮ�����ã�����c(A-)>c(Na+)��B����
C.����H2B��HA��HB-����Na2B��Һ�м���������HA��Һ������Ӧ�����ӷ���ʽΪ��B2-+HA=A-+HB-��C����
D.���������غ�ɵ�NaHB��Һ�в�����Ũ�ȵĹ�ϵΪc(Na+)=c(HB-) +c(H2B)+c(B2-)����D��ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�ֻ�������Ӽ��Ļ������ǣ� ��
A. H2OB. CaCl2C. KOHD. Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ij�¶��£���2m g 16%��CuSO4��Һ�м���m g CuSO45H2O����Һǡ�ôﵽ���ͣ��ñ�����Һ��CuSO4����������Ϊ_____��
(2)��״���£�1���ˮ���ܽ�V���HCl���壬������Һ���ܶ�Ϊ��g/cm3����������Һ���ʵ�����������ʾΪ_____�����ʵ����ʵ���Ũ�ȱ�ʾΪ_____��
(3)������1����2�ֱ��ʾŨ��Ϊa molL��1��b molL��1������Һ�����ʵ�������������֪ 2a��b���������ƶ���ȷ����(������Һ���ܶȱȴ�ˮ�Ĵ�)_____(�����)
A. 2��1����2 B. ��2��2��1 C. ��2��2��1 D. ��1����2��2��1
(4)������1����2�ֱ��ʾŨ��Ϊa molL��1��b molL��1��ˮ�����ʵ�������������֪2��1����2���������ƶ���ȷ����(��ˮ���ܶȱȴ�ˮ��С)_____(�����)
A. 2a��b B. 2a��b C. 2a��b D. a��b��2a��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ϡ��Һ�ǿ���ǿ����кͷ�Ӧ����1 molҺ̬ˮʱ��Ӧ�Ƚ����к��ȡ���������ͼװ�ý����к��ȵIJⶨ����ش��������⣺

(1)ͼ��δ������ʵ��������________________��________________��
(2)��һ���������к��Ȳⶨʵ�飬�¶ȼ���ʹ��________�Ρ�
(3)ʵ��ʱ����0.50 mol��L��1��������뵽0.55mol��L��1��NaOH��Һ�У�������Һ�������Ϊ50 mL������Һ���ܶȾ�Ϊ1 g /cm3��������Һ�ı�����c=4.18 J /(g�� oC)��ʵ�����ʼ�¶�Ϊt1 oC����ֹ�¶�Ϊt2 oC������¶ȱ仯�������£�
��� | ��Ӧ�� | ��ʼ�¶�t1/ oC | ��ֹ�¶�t2/ oC | �к��� |
�� | HCl��NaOH | 14.8 | 18.3 | ��H1 |
�� | HCl��NaOH | 15.1 | 19.7 | ��H1 |
�� | HCl��NaOH | 15.2 | 18.5 | ��H1 |
�� | HCl��NH3��H2O | 15.0 | 18.1 | ��H2 |
���Լ�����������ʵ�������к�����H1��______________��
��ijС��ͬѧΪ̽��ǿ���������ϡ��Һ��Ӧʱ�������仯���ֶ�����һ��ʵ��ܣ���0.55mol��L��1��ϡ��ˮ����NaOH��Һ������¶ȵı仯��������У��Լ��㷴Ӧ����H2��____________��
������ʵ���������ԭ����___________________________________________��
��д��HCl��NH3�� H2O��Ӧ���Ȼ�ѧ����ʽ��_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���췯��(Na2Cr2O7��2H2O)����Ҫ�Ļ���ԭ�ϣ���ҵ���ø�����(��Ҫ�ɷ���FeO��Cr2O3)�Ʊ��췯�ƵĹ����лᷢ�����·�Ӧ��
4FeO(s)��4Cr2O3(s)��8Na2CO3(s)��7O2(g) ![]() 8Na2CrO4(s)��2Fe2O3(s)��8CO2(g)����H<0
8Na2CrO4(s)��2Fe2O3(s)��8CO2(g)����H<0
(1)��ͼΪ������Ӧ��Ũ����ʱ��ͼ����ͼ���жϷ�Ӧ������t2ʱ��ʱ���ı��������_________________________����ͼΪ������Ӧ��������ʱ��ͼ��ʾ������Ӧ��t1ʱ�ﵽƽ�⣬ ��t2ʱ��ı�ij��������ʹ���߷����仯����ͼ�жϣ�t2ʱ�����߱仯��ԭ�������________(��д���)��
a�������¶� b���Ӵ���
c��ͨ��O2 d����С�������

(2)��ҵ�Ͽ�����������Ӧ�ĸ�����CO2�������״���CO2(g)��3H2(g) ![]() CH3OH(g)��H2O(g)��
CH3OH(g)��H2O(g)��
��һ���¶��£����ݻ�Ϊ1L���ܱ������У�����2 mol CO2��4 mol H2��һ��ʱ���ﵽƽ�⣬���CH3OH�����ʵ���Ũ��Ϊ1mol/L������¶��´˷�Ӧ��ƽ�ⳣ��Ϊ_________��ijʱ�̲��CO2��H2��CH3OH��H2O�����ʵ����ֱ�Ϊ2mol��1mol��1mol��1mol������һʱ��v(��)___________v(��)
����T1�¶�ʱ����1 mol CO2��3 mol H2����һ�ܱ������У���ַ�Ӧ�ﵽƽ���CO2ת����Ϊ�����������ڵ�ѹǿ����ʼѹǿ֮��Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��ˮ�ĵ���ɴﵽƽ�⣺H2O![]() H++OH- ��H>0������������ȷ����
H++OH- ��H>0������������ȷ����
A. ��ˮ�м���ϡ��ˮ��ƽ�������ƶ���c(OH-)����
B. ��ˮ���ȣ�Kw����pH����
C. ��ˮ�м�������CH3COONa���壬ƽ�������ƶ���c (H+)����
D. ��ˮ�м������������������ƣ�c(H+)����Kw����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ˮϵ�����ӵ�ع���ԭ������ͼ��ʾ��TiO2��缫��ʹ�����̫�������³�磬���ʱ Na2S4ת��Ϊ Na2S������˵����ȷ����
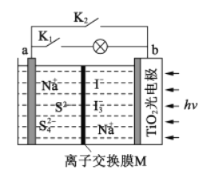
A. ���ʱ��̫����ת��Ϊ��ѧ�ܣ���ѧ����ת��Ϊ����
B. �ŵ�ʱ��a��Ϊ����
C. ���ʱ�������ĵ缫��ӦʽΪ3I--2e-=I3-
D. M����ʹ�������ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�ˮ����Ҫ��ˮ���Ȼ��ƣ�����������þ���ӵȣ�����ȡþ���ɰ����²�����У�
�ٰѱ��ǣ���Ҫ�ɷ�̼��ƣ��Ƴ�ʯ���飨�������Ƶ�����Һ����
��������ĺ�ˮ�м���ʯ���飬���������ˡ�ϴ�ӳ������Ҫ��������þ����
�۽������������ᷴӦ���ᾧ���ˡ���HCl�����Χ�и������õ��Ȼ�þ���
�ܽ��õ��IJ������ڵ��õ�þ��
����˵������ȷ����
A. ��ˮ�м����������������ɫ����
B. ��������漰�������ӷ�Ӧ����ʽΪ2OH��+Mg2��=Mg(OH)2��
C. �٢ڢ۲����漰���ϡ��ֽ���ֽⷴӦ
D. �ڢܲ��ķ�Ӧ���ڷֽⷴӦҲ��������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���1 L�����ܱ������м���1 mol��N2(g)��3 mol H2(g)������Ӧ��N2(g)��3H2(g)![]() 2NH3(g)����H<0��NH3�����ʵ�����ʱ��Ĺ�ϵ�����ʾ������˵���������(����)
2NH3(g)����H<0��NH3�����ʵ�����ʱ��Ĺ�ϵ�����ʾ������˵���������(����)
ʱ��/min | 0 | t1 | t2 | t3 |
NH3���ʵ���/mol | 0 | 0.2 | 0.3 | 0.3 |
A. 0��t1 min��v(NH3)��0.2/t1 mol��L��1��min��1
B. �����¶ȣ���ʹ����Ӧ���ʼ�С���淴Ӧ��������ƽ�������ƶ�
C. N2(g)��3H2(g)![]() 2NH3(g)�Ļ��С��2NH3(g)
2NH3(g)�Ļ��С��2NH3(g)![]() N2(g)��3H2(g)�Ļ��
N2(g)��3H2(g)�Ļ��
D. t3 minʱ�ټ���1 mol��N2(g)��3 mol H2(g)����Ӧ�ﵽ��ƽ��ʱ��c(N2)>0.85 mol��L��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com