
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g) ![]() CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D. 对于反应2HI(g) ![]() H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:______________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是________反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是__________________________;乙的作用是__________________________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________________。集气瓶中收集到的气体的主要成分是__________________________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有__________。要除去该物质,可先在混合液中加入________________(填写字母)。
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________________(填实验操作名称)即可除去。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X和Y中,X原子的最外层电子数是内层电子总数的一半,Y元素在X元素的前一周期,Y2离子和Ne原子的电子层结构相同。有关X和Y形成的化合物Z的说法中,正确的是
A. Z肯定不是酸酐B. Z是一种碱性氧化物
C. Z的分子式可能是X2Y5D. Z是一种离子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】A (C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):
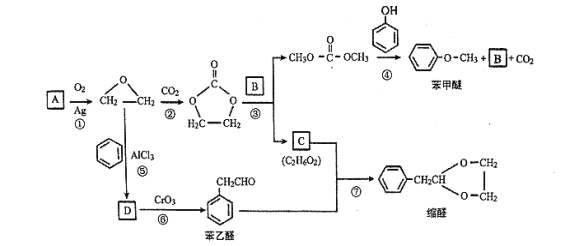
已知:![]()
回答下列问题:
(1)B的分子式是_______,C中含有的官能团名称是_______。
(2)若D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子, D中氧元素的质量分数约为13.1%,则D的结构简式为_______,⑥的反应类型是_______。
(3)据报道,反应⑦在微波辐射下,以NaHSO4·H2O为催化剂进行,请写出此反应的化学方程式:_______。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:_______。
i .含有苯环和结构![]()
ii.核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1
(5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色的E的所有同分异构体共有_______ (不考虑立体异构)种。
(6)参照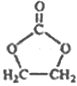 的合成路线,写出由2-氯丙烷和必要的无机试剂制备
的合成路线,写出由2-氯丙烷和必要的无机试剂制备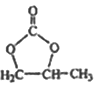 的合成流程图:_______。
的合成流程图:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,电池反应如下:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+2H2O,根据此反应判断下列叙述中正确的是( )
A.电池放电时,PbO2是负极;充电时,PbO2是电池的阳极
B.负极的电极反应式为:Pb+SO42﹣﹣2e﹣=PbSO4
C.放电时,PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
查看答案和解析>>
科目: 来源: 题型:
【题目】一定质量的乙烯,完全燃烧时放出的热量为Q,完全吸收燃烧后所生成的CO2气体需要200mL 2mol/L的NaOH溶液,则28g乙烯完全燃烧放出的热量不可能是
A. 5QB. 5Q~10QC. 10QD. 大于10Q
查看答案和解析>>
科目: 来源: 题型:
【题目】C、N、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) =2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) =2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2O(1)=2HCl(aq)+H2SO4 (aq) △H4=__________(用含有△H1、△H2和△H3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图所示。

已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因 ____________________。
(3)利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

①放电时,正极的电极反应式为______。
②选用高氯酸钠—四甘醇二甲醚做电解液的优点是_______(至少写两点)。
(4)氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
①一氯胺(NH2Cl)的电子式为_______。一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_______。
②在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:

计算C点时该反应的压强平衡常数Kp(C)= _______ (Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定的温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是
2C(g)达到平衡的标志是
A. C分解速率与B生成速率相等B. A、B、C的浓度不再变化
C. 单位时间生成n mol A,同时生成3n molBD. A、B、C的分子数之比为1:3:2
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示,△H1=-393.5 kJmol-1,△H2=-395.4 kJmol-1,下列说法或表示式正确的是( )

A. C(s、石墨)==C(s、金刚石)△H=+1.9kJmol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】H2、N2合成NH3的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是
A. v(N2)=0.6mol/(L·min)B. v(NH3)=0.9mol/(L·min)
C. v(H2)=1.2mol/(L·min)D. v(H2)=0.025mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com