
科目: 来源: 题型:
【题目】在不同温度下,向V L密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:
2NO(g)+C(s)![]() N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
温度/℃ | n (C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是
A. 由上述信息可推知:T1 > T2
B. T2℃时,若反应达平衡后再缩小容器的体积,c (N2):c (NO)增大
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大
D. T1℃时,该反应的平衡常数![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】一种将CO2和H2O转换为燃料H2、CO及CH4的装置如图所示(电解质溶液为稀H2SO4)。下列关于该装置的叙述错误的是

A. 该装置可将电能转化为化学能
B. 工作时,电极a周围溶液的pH增大
C. 电极b上生成CH4的电极反应式为CO2+8H++8e-===CH4+2H2O
D. 若电极b上只产生1 mol CO,则通过质子膜的H+数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是

A. 整个过程中O3作催化剂
B. 反应III的方程式为O2+O===O3
C. 光化学烟雾中含甲醛、乙醛等刺激性物质
D. 反应I、反应Ⅱ均属于氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,下列各组数据中比值为2:1的是( )
A. 0.2 mol/L的CH3COONa溶液与0.1 mol/L的CH3COONa溶液中c(CH3COO-)之比
B. pH=7的氨水与(NH4)2SO4的混合溶液中c(NH4+)与c(SO42-)之比
C. 等质量的Na2CO3固体和NaHCO3固体分别与足量盐酸反应,消耗盐酸的物质的量之比
D. pH均为2的H2SO4溶液与盐酸中c(H+)之比
查看答案和解析>>
科目: 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分。
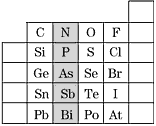
(1)上图中元素N在元素周期表中的位置为_________________,根据元素周期律,请预测H3AsO4、H3PO4的酸性强弱:H3AsO4________H3PO4(填“强于”或“弱于”)。
(2)上图中元素O、S、Se的氢化物的沸点由高到低为:________>________>________。(用化学式填写)_____________
(3)写出S2-的离子结构示意图为______________;判断表中Bi和Te两种元素的金属性强弱:Bi________Te(填“<”或“>”或“=”)。
(4)Br2具有较强的氧化性,SO2具有较强的还原性,请写出将SO2气体通入溴水中反应的离子方程式:________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将淀粉水解,并用新制Cu(OH)2悬浊液检验其水解产物的实验中,要进行的主要操作有:①加热;②滴入稀硫酸;③加入新制Cu(OH)2悬浊液;④加入足量的氢氧化钠溶液。以上操作步骤的先后顺序排列正确的是
A. ①②③④① B. ②①③④①
C. ②④①③① D. ②①④③①
查看答案和解析>>
科目: 来源: 题型:
【题目】对于工业制H2SO4过程中的反应:2SO2(g)+O2![]() 2SO3(g)下列说法错误的是
2SO3(g)下列说法错误的是
A. 使用合适的催化剂可以加快化学反应速率
B. 增大O2浓度可以使SO2转化率达到100%
C. 降温时,反应速率减小
D. 缩小密闭容器的体积,可以加快反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】NaC1O3可用于制取二氧化氯、亚氯酸钠及高氯酸盐等。以原盐(主要成分为NaC1)为原料制备氯酸钠的工艺流程如下:

已知:Cr2O72-+H2O![]() 2CrO42-+2H+。
2CrO42-+2H+。
回答下列问题:
(1)“粗制盐水”中加入NaOH和Na2CO3的目的是___________________。
(2)过滤时,使用的玻璃仪器有烧杯、玻璃棒和____________。
(3)在pH:6.4~6.8,温度:40~50℃的条件下电解,理论上最终产物只有NaC1O3。电解时阳极的产物为C12,溶液中发生的反应有C12+H2O====HC1O+H++C1-,HC1O![]() H++C1O-和__________。
H++C1O-和__________。
(4)电解槽中温度不宜过高,其原因是_________________________。加入的Na2Cr2O7可以调节电解液酸度,若酸度过大,则电解液中主要存在__________(填“Cr2O72-”或“CrO42-”)。
(5)为检测电解后盐水中NaC1O3的物质的量浓度进行下列实验:
I.准确吸取10.00mL电解后的盐水,加入适量的3%H2O2溶液充分搅拌并煮沸。
Ⅱ.准确吸取0.10mol·L-1的(NH4)2Fe(SO4)2标准溶液25.00 mL于300mL锥形瓶中,加入足量稀硫酸。
III.将I的溶液加入Ⅱ的锥形瓶中,隔绝空气煮沸10min,加热充分反应。冷却至室温后,加入10mL0.4mol·L-1MnSO4溶液、5mL 85%磷酸溶液,用c mol·L-1的KMnO4标准溶液滴定剩余的Fe2+至溶液变为微红色,即滴定终点,此时消耗高锰酸钾V mL。
①步骤I中加入H2O2溶液的作用是______________________。
②步骤Ⅱ中C1O3-被Fe2+还原为C1-的离子方程式为________________________。
③该盐水中NaC1O3的物质的量浓度为________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是 ( )
A.离子化合物中一定不含共价键
B.共价化合物中一定不含离子键
C.两种元素组成的化合物中一定只含有一种化学健
D.由于水分子之间存在氢键,所以水分子比较稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com