
科目: 来源: 题型:
【题目】以下是生物体内四种有机物的组成与功能关系图,如图1,请据图回答:

(1)小麦种子细胞中,物质A是______________,物质E是______________。艾滋病毒中的H彻底水解后可以得到________种产物。
(2)相同质量的E和F彻底氧化分解,耗氧量较多的是___________。
(3)若a个C物质组成b条链,组成某种物质G,该物质G至少含有氧原子的个数是________。若G是一条含121个氨基酸构成的链状结构,其中含5个甘氨酸(其R基为-H),分别位于26、71、72、99、121位(见下图)。
![]()
肽酶E1专门水解甘氨酸羧基端的肽键,肽酶E2专门水解甘氨酸氨基端的肽键。肽酶E1完全作用后产生的多肽中,至少有________个羧基。
(4)图二表示小麦开花数天后测定的种子中主要物质的变化图,请据图回答问题:
①小麦成熟种子中主要的有机营养物质是________,检测可溶性还原糖的试剂是_________,可溶性还原糖的多少可以通过________________来判断。
②种子成熟时,淀粉的形成与一种磷酸化酶的活性有密切关系,为了验证磷酸化酶是否为蛋白质,实验过程中实验组试管中加入2ml________,对照组试管中加入_______,然后在两支试管中分别加入等量双缩脲试剂,如果实验组试管中同样出现____________现象,则证明磷酸化酶是蛋白质。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学学习小组进行如下实验:
Ⅰ.探究反应速率的影响因素 设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L - 1 H2C2O4溶液、0.010 mol·L -1KMnO4 溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽

(1)若上述实验②、③是探究浓度对化学反应速率的影响,则 a 为______________;乙是实验需要测量的物理量,则表格中“乙”应 填写__________________。
Ⅱ.测定 H2C2O4·xH2O 中 x 值 已知:M(H2C2O4)=90 g·mol-1 ① 称取 1.260 g 纯草酸晶体,将草酸制成 100.00 mL 水溶液为待测液; ② 取 25.00 mL 待测液放入锥形瓶中,再加入适量的稀 H2SO4; ③ 用浓度为 0.05 000 mol·L -1 的 KMnO4 标准溶液进行滴定。
反应原理为:5 H2C2O4 + 2 MnO4— + 6H+ = 10CO2↑+ 2Mn2+ + 8H2O
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是________(选填 a、b)。由图可知消耗 KMnO4 溶液体积为________ mL。

(3)滴定终点锥形瓶内现象为__________________________________________________。
(4)通过上述数据,求得 x=______________。
(5)下列操作会造成所测x偏大的是____________(填字母)。
A.滴定终点俯视读数
B.锥形瓶用待测溶液润洗
C.滴定前有气泡,滴定后没有气泡
D.配制100mL待测溶液时,有少量溅出
查看答案和解析>>
科目: 来源: 题型:
【题目】在2A+B=3C+4D反应中,表示该反应速率最快的数据是
A. v(A)=0.5mol·L-1·s-1 B. v(B)=3mol·L-1·min-1
C. v(C)=0.9mol·L-1·s-1 D. v(D)=1.0mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验。请完成下列填空:
(1)配制500mL 0.1000mol·L-1 NaOH 标准溶液。
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、__________、__________等。
②称取__________g氢氧化钠固体所需仪器有天平(带砝码、镊子)、药匙、__________
(2)取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用__________(填仪器名称)盛装配制的标准NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
滴定次数 | 待测盐酸 的体积/mL | 标准NaOH溶液体积 | |
滴定前的刻度/mL | 滴定后的刻度/rnL | ||
第一次 | 20.00 | 0.40 | 20.50 |
第二次 | 20.00 | 4.10 | 24.00 |
第三次 | 20.00 | 1.00 | 24.00 |
(3)①如何判断滴定终点:____________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________mol·L-1。
③排去碱式滴定管中气泡的方法应采用下图操作中的__________(填序号),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)在上述实验中,下列操作(其他操作正确)会造成测定果偏低的有__________(填序号)。
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体中混有Na2CO3固体
D.滴定终点读数时俯视读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应:N2(g)+O2(g)![]() 2NO(g)ΔH >0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
2NO(g)ΔH >0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为_____________________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________ 。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下图变化趋势正确的是____________(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数________。(填“变大”、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和3.0×10-3 mol·L-1,此时反应___________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:2NO(g) + O2(g) ![]() 2NO2(g) △H= -113.0 kJ·mol-1,2SO2(g)+ O2 (g)
2NO2(g) △H= -113.0 kJ·mol-1,2SO2(g)+ O2 (g) ![]() 2SO3(g) △H=-196.6 kJ·mol-1,SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
2SO3(g) △H=-196.6 kJ·mol-1,SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
① 写出NO2和SO2反应的热化学方程式为__________________________。
② 随温度升高,该反应化学平衡常数变化趋势是____________。(填“增大”或“减小”或“不变”)
(2)提高2SO2 + O2![]() 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
① T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,该温度下反应的平衡常数K=_______。
② 在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_________(填字母)。
a.温度和容器体积不变,充入1.0 mol He b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,升高体系温度
(3)汽车尾气是氮氧化物的一个主要来源。汽缸中生成NO的反应为:N2 (g) + O2 (g) ![]() 2NO(g) △H>0
2NO(g) △H>0
汽车启动后,汽缸温度越高,单位时间内NO的排放量越大,其原因是_______________。
(4)研究人员在汽车尾气系统中装置催化转化剂,可有效降低NOx的排放。
① 写出用CO还原NO生成N2的化学方程式____________________。
② 在实验室中模仿此反应,在一定条件下的密闭容器中,测得NO转化为N2的转化率随温度变化情况和n (NO)/n(CO)比例变化情况如下图。
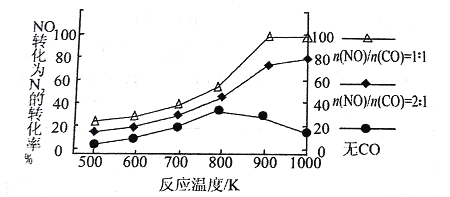
为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别 为________、________;该反应的H________0(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:
(1)AlCl3的水溶液pH______7(填>、=、<),其原因为______________(用离子方程式表示),将其溶液加热蒸干并灼烧最终得到物质是______(填化学式)。
(2)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要使c(Cr3+)降至105mol/L,溶液的pH应调至_____。
(3)物质的量浓度相同的三种溶液:①NH4Cl ②氨水 ③NH4HSO4,c(NH4+)大小顺序正确的是______________。 (用序号表示)
(4)常温下两种溶液:a.pH=4 NH4Cl b.pH=4盐酸溶液,其中水电离出C(H+)之比为____________________。
(5)室温,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液的pH=6,则NaOH溶液与盐酸的体积比为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关。下列说法正确的是
A. 垃圾分类中可回收物标志:![]()
B. 农谚“雷雨肥庄稼”中固氮过程属于人工固氮
C. 绿色化学要求从源头上减少和消除工业生产对环境的污染
D. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
查看答案和解析>>
科目: 来源: 题型:
【题目】沙罗特美是一种长效平喘药,其合成的部分路线如下:
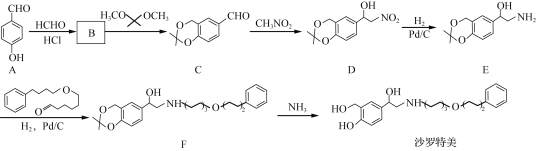
(1)F中的含氧官能团名称为____________(写两种)。
(2)C→D的反应类型为____________。
(3)B的分子式为C8H8O3,与(CH3)2C(OCH3)2发生取代反应得到物质C和CH3OH,写出B的结构简式:________。
(4)写出同时满足下列条件的E的一种同分异构体的结构简式:__________。
①分子中含有苯环,且有一个手性碳原子,不能与FeCl3发生显色反应;
②能发生水解反应,水解产物之一是α氨基酸,另一含苯环的水解产物分子中只有3种不同化学环境的氢。
(5)请写出以 、(CH3)2C(OCH3)2、CH3NO2为原料制备
、(CH3)2C(OCH3)2、CH3NO2为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _____。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _____。
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列转化过程的化学方程式。单质、氧化物、酸、碱和盐的相互关系,可以用下图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复)。
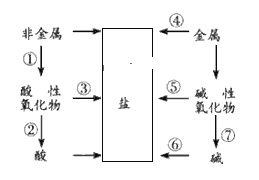
①______,②_______,③_______,④________,⑤____,⑥_______,⑦______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com