
科目: 来源: 题型:
【题目】MoS2(辉钼矿的主要成分)可用于制取钼的化合物润滑添加剂氢化反应和异构化反应的催化剂等。回答下列问题:
(1)反应3MoS2+18HNO3+12HCl=3H2[MoO2Cl4]+18NO↑+6H2SO4+6H2O中,每溶解1mol MoS2,转移电子的物质的量为___________。
(2)已知:MoS2(s)= Mo(s)+S2(g) △H1
S2(g)+2O2(g)=2SO2(g) △H2
2MoS(s)+7O2(g)=2MoO3 (s)+4SO2(g) △H3
反应2Mo(s)+3O2(g)=2MoO3(s)的△H=___________(用含△H1、△H2、△H3的代数式表示)。
(3)利用电解法可浸取辉钼矿得到Na2MoO4和Na2SO4溶液(装置如图所示)。

①阴极的电极反应式为______________________。
②一段时间后,电解液的pH___________ (填“增大”“减小”或“不变”),MoO42-在电极___________(填“A”或“B”)附近生成。
③实际生产中,惰性电极A一般不选用石墨,而采用DSA惰性阳极(基层为TiO2,涂层为RuO2+IrO2),理由是_______________________。
(4)用辉钼矿冶炼Mo的反应为
MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。
①该反应的△H___________(填“>”或“<”)0;p1、p2、p3按从小到大的顺序为___________。
②在某恒容密闭容器中加入0.1 mol MoS2、0.2mol Na2CO3、0.4mol H2,一定温度下发生上述反应,下列叙述说明反应已达到平衡状态的是____________ (填标号)。
a.v正(H2)=v逆(CO)
b.气体的密度不再随时间变化
c.气体的压强不再随时间变化
d单位时间内断裂H一H键与断裂H—O键的数目相等
③在2L的恒温恒容密闭容器中加入0.1 mol MoS2、0.2 mol Na2CO3、0.4molH2,在1100K时发生反应,达到平衡时恰好处于图中A点,则此温度下该反应的平衡常数为___________。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关同分异构体数目的叙述错误的是()
A.  与Cl2在光照条件下的取代产物有3种
与Cl2在光照条件下的取代产物有3种
B. 分子式为C7H8O且属于芳香族化合物的同分异构体有5种
C. 丙烷的一氯代物有2种,丙烷的二氯代物有4种
D. 联苯![]() 的一氯代物有3种,二氯代物有12种
的一氯代物有3种,二氯代物有12种
查看答案和解析>>
科目: 来源: 题型:
【题目】设阿伏加德罗常数为NA,则下列说法正确的是
A.15g甲基(-CH3)所含有的电子数是9NA
B.7.8g ![]() 中含有的碳碳双键数为0.3NA
中含有的碳碳双键数为0.3NA
C.1mol C2H5OH和1mol CH3CO18OH反应生成水的中子数为8NA
D.标准状况下,11.2L己烷所含分子数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.01mol I2和0.01mol H2置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为456 kPa。体系中存在以下反应关系:
I2(g)![]() 2I(g) △H1 Kp1=2.00
2I(g) △H1 Kp1=2.00
HI(g)![]() I(g)+H(g) △H2 Kp2
I(g)+H(g) △H2 Kp2
H2(g)![]() 2H(g) △H3 Kp3=8×10-6
2H(g) △H3 Kp3=8×10-6
I2(g)+H2(g)![]() 2HI(g) △H4 Kp4
2HI(g) △H4 Kp4
回答下列问题:
(1) △H4与△H1、△H2、△H3的关系是_________________________。
(2) I2(g)+H2(g)![]() 2HI(g)反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时,v正________(填“>”“<”“=”)v逆,前5minHI的生成率v(HI)=_____________________。
2HI(g)反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时,v正________(填“>”“<”“=”)v逆,前5minHI的生成率v(HI)=_____________________。
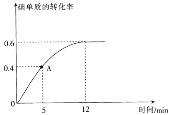
(3)达到平衡状态时,氢气的物质的量分数是________________;Kp4=________________(Kp为用平衡分压代替浓度表示的平衡常数,平衡分压=总压×物质的量分数)。
(4)下列说法能说明该体系达到平衡状态的是________________。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5)HI是一种强酸,常温下将1.0mol·L-1的HI溶液和amol·L-1的氨水等体积混合后,溶液呈中性此时溶液中离子浓度的大小关系是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g)![]() H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
A.升高温度 B.加入催化剂
C.再加入n molCO和n molH2O D.再加入2n molCO2和2n molH2
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列物质中,属于强电解质的是(填序号,下同)__________,属于弱电解质的是________,属于非电解质_____________;
①氨气 ②氨水 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥氯化银 ⑦氯化钠 ⑧二氧化碳 ⑨醋酸铵 ⑩氢气
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:__________________。
(3)甲、乙两瓶氨水的浓度分别为1 molL-1、0.1 molL-1,则c(OH﹣)甲 :c(OH﹣)乙_________10(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=_____________,ΔH________0(填“>”、“<”或“=”);
(2)在一个容积为5L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时比较v(正)___v(逆) (填“>” “=” “<”),反应经过2min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=____,CO的平衡转化率=____________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A、减少Fe的量 B、增加Fe2O3的量 C、移出部分CO2 D、提高反应温度 E、减小容器的容积 F、加入合适的催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向0.10mol·L-1的H2C2O4(二元弱酸)溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法不正确的是

A. 25℃时H2C2O4的一级电离常数为Ka1=104.3
B. pH=2.7的溶液中:c(H2C2O4)=c(C2O42-)
C. pH=7的溶液中:c(Na+)>2c(C2O42-)
D. 滴加NaOH溶液的过程中始终存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铅(PbCl2)常用于焊接和制备铅黄等染料。利用从废旧铅蓄电池中得到的铅膏获取氯化铅的流程如图,试回答下列问题:

已知:①铅膏主要由PbSO4、PbO、PbO2和Pb等组成。
②流程图中的“1”表示液体,“s”表示固体。
③硫酸铅、氯化铅微溶于水,但氯化铅能溶于NaCl溶液中,主要发生反应:PbCl2+Cl-==[PbCl3]-。
(1)铅蓄电池的正极材料是________________(填化学式),放电时负极的电极反应式为________。
(2)“浸取反应”是在加热条件下,用盐酸和氯化钠溶液浸取铅膏的过程,主要发生反应的方程式有PbP
PbO2+Pb+4HCl==2PbCl2+2H2O PbO+2HCl==PbCl2+H2O,
PbSO4+2NaCl==PbCl2+Na2SO4 PbCl2+Cl-=[PbCl3]-
除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是________________;该浸取过程中Pb与盐酸反应产生的H2可能会与________ (填气体名称,下同)、________等混合发生爆炸。
(3)PbCl2(溶液显酸性)在氯化钠溶液中的溶解度随温度的升高而增大,适当地升高温度有利于提高铅的浸取率,当温度高于70℃时,浸取率提高不明显,可能的原因是________________________________;为了提高浸取率,还可以采取的措施是________________________________________。
(4)在室温下静置冷却3h后,过滤得到的氯化铅的回收率可达到85%,过滤后得到的滤液进行循环使用可提高铅的利用率。在循环使用之前需加入氯化钙将SO42-进行沉淀转化,若无此步骤,直接循环使用,溶液中SO42-浓度过大,则会导致的结果是________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com