
科目: 来源: 题型:
【题目】明矾[KAl(SO4) 2 ·12H2O]易溶于水,不易溶于乙醇,在生产、生活中有广泛用途。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量的SiO2、FeO·xFe2O3)制备明矾的工艺流程如下:

回答下列问题:
(1)酸浸时为提高铝的浸取率,可采取的措施是_________(填标号)。
a.改用同浓度的硝酸 b.用硫酸多次浸取
c.浸取时间缩短一半 d.适当升高温度
(2)滤渣1的成分是__________;滤渣2经过处理可以制得一种高效的无机高分子混凝剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为___________。
(3)检验滤液A中含有Fe2+的实验方案及现象是________________________________________。
(4)已知常温下Ksp[Fe(OH)3]=4.0×10-38,当调节溶液的pH=3时,溶液中c(Fe3+)=____________。
(5)操作Ⅱ中包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,使用酒精洗涤明矾晶体的目的是___________________________________________________________________;明矾净水的原理是_______________________________________(写离子方程式)。
(6)已知在pH=3和加热条件下,MnO4-可与Mn2+反应生成MnO2,则上述流程图中加入适量MnSO4发生反应的离子方程式为_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列四种粒子中,半径按由大到小排列顺序正确的是
①基态X的原子结构示意图
②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图![]()
④W基态原子有2个能层,电子式为![]()
A. ①>②>③>④ B. ③>④>①>②
C. ③>①>②>④ D. ①>②>④>③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+ =CO2↑+H2O
C.实验室用浓盐酸与MnO2制备氯气:MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
D.过氧化钠与水反应:2Na2O2+2H2O=4OH-+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度的物理量,已知如表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为_____(填字母,下同)。
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生的化学方程式为____________________。
(3)等物质的量的Na2CO3和NaHCO3混合溶液中各离子浓度由大到小的顺序为____________________。
(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是__________。
a.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小
b.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解
c.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离
d.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离
(5)25℃,已知pH = 2的高碘酸溶液与pH = 12的NaOH溶液等体积混合,所得混合液显酸性;0.01 mol/L的碘酸或高锰酸溶液与pH = 12的NaOH溶液等体积混合,所得混合液显中性。则高碘酸是____________(填“强酸”或“弱酸”);高锰酸是___________(填“强酸”或“弱酸”)。将可溶性的高碘酸钡[Ba5(IO6)2]与稀硫酸混合,发生反应的离子方程式为:__________________________________________________。
(6)用生石灰吸收CO2可生成难溶电解质CaCO3,其溶度积常数Ksp=2.8×10-9。现有一物质的量浓度为2×10-4mol/L纯碱溶液,将其与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为______mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸晶体的组成可用H2C2O4·2H2O(M=126g/mol)表示,其中混有不参与反应的杂质,为了测定草酸晶体的纯度,进行如下实验:称取m g样品,配成250mL水溶液。量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为c mol·L-1的KMnO4溶液滴定,所发生的反应: KMnO4+ H2C2O4+ H2SO4 = K2SO4+ CO2↑+ MnSO4+ H2O。试回答:
(1)写出该反应的离子方程式并配平:_________________________________________,该反应发生时产生气体先慢后快的原因是_______________________________________________
(2)实验中,KMnO4溶液应装在_____式滴定管中,因为 ___________________。
(3)滴定过程中需要加入的指示剂为___________(填指示剂的名称或“不需要”),确定反应达到滴定终点时的现象是______________________________________。
(4)下列操作会导致测定结果偏低的是_________________________。
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(5)在滴定过程中若用c mol·L-1的KMnO4溶液V mL,则所配制的草酸溶液的物质的量浓度为___mol·L-1,由此可计算样品中草酸晶体的纯度是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能符合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1=-285.8kJ/mol
C8H18 (1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH3=-5518kJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式________
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-53.7 kJ·mol-1平衡常数 K1
CH3OH(g)+H2O(g) △H=-53.7 kJ·mol-1平衡常数 K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H=+41.2 kJ·mol-1平衡常数K2
CO(g)+H2O(g) △H=+41.2 kJ·mol-1平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 71.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)=CH3OH(g)。在体积均为2L的三个恒容密闭Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。图1为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。CO的平衡转化率在不同压强下随温度的变化如图所示。

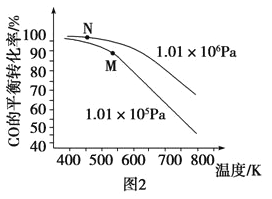
①0~5 min时间内容器Ⅱ中用CH3OH表示的化学反应速率为__________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
③工业实际合成CH3OH生产中,采用图2中M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列问题:
(1)下列各化合物中,属于同系物的是_____,属于同分异构体的是___填入编号

![]()
F.戊烯和环戊烷
(2)反—2-丁烯的结构简式_________________________;
(3)2,6–二甲基–4–乙基辛烷的结构简式:_______;1mol该有机物完全燃烧耗氧气_______________mol。
(4) CH3-CH(C2H5) – C(C2H5)=CH-CH3的系统命名的名称为___________________;
(5)某烷烃分子里含有9个碳原子,且其一氯代物只有2种,则该烷烃的系统命名的名称是______。
(6)  单体的结构简式________________。
单体的结构简式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(l)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是________,B原子的杂化轨道类型是_____________。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/ kJ·mol-1 | I2/ kJ·mol-1 | I3/ kJ·mol-1 | I4/ kJ·mol-1 | I5/ kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____ (填元素符号),判断理由为________________________。
(2)铜晶体中铜原子的堆积方式如图24所示,铜晶体中原子的堆积模型属于______。

(3)A原子的价电子排布式为3s23p5,铜与A形成化合物的晶胞如图25所示(黑点代表铜原子)。
①该晶体的化学式为______________________。
②该化合物难溶于水但易溶于氨水,其原因是_______________________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______________________。
③已知该晶体的密度为pg . cm-3,阿伏伽德罗常数为NA,已知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为______pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | 酸的强弱:HX<HY |
B | 向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
C | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
D | 常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH | pH:NaA>NaB | 常温下酸性:HA﹤HB |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】银锌蓄电池应用广泛,放电时总反应为Zn+Ag2O2+H2O==Zn(OH)2+Ag2O,某小组以银锌蓄电池为电源,用惰性电极电解饱和Na2SO4溶液制备H2SO4和NaOH,设计如图所示装置。连通电路后,下列说法正确是

A. 电池的a极反应式为Ag2O2+H2O+2e-=Ag2O+2OH-
B. 气体Y为H2
C. pq膜适宜选择阳离子交换膜
D. 电池中消耗65gZn,理论上生成1mol气体X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com