
科目: 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )。
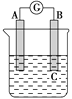
A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种可再生的绿色能源,![]() 是一种温室气体,都是重要的化工原料。
是一种温室气体,都是重要的化工原料。
(1)已知CO的燃烧热![]() 为
为![]() ,CO(g)+2H2(g)
,CO(g)+2H2(g)![]() CH3OH(1);△H=-129kJmol-1,欲求出
CH3OH(1);△H=-129kJmol-1,欲求出![]() 的燃烧热,则需要知道一个反应,该反应的热化学方程式为____________________.(无需写出
的燃烧热,则需要知道一个反应,该反应的热化学方程式为____________________.(无需写出![]() 的具体数值)
的具体数值)
(2)向温度不同容积均为1L的a、b、c、d、e五个恒容密闭容器中各充入![]() 、
、![]() 的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)
的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=QkJmol-1,反应过程中维持各容器温度不变,测得
CH3OH(g)+H2O(g)△H=QkJmol-1,反应过程中维持各容器温度不变,测得![]() 时刻各容器中
时刻各容器中![]() 的体积分数(H2O)如图所示。
的体积分数(H2O)如图所示。

①Q_______(填“>”或“<”)0,五个容器中肯定处于非平衡状态的是_________。
②![]() 时刻时,容器a中正反应速率________(填“大于”“小于”或“等于”)容器e中正反应速率;
时刻时,容器a中正反应速率________(填“大于”“小于”或“等于”)容器e中正反应速率;
③![]() ℃时,该反应的平衡常数K=__________;
℃时,该反应的平衡常数K=__________;
④欲提高![]() 的转化率,可采取的措施有______________________(写出两种);
的转化率,可采取的措施有______________________(写出两种);
(3)碳捕捉技术的应用既可降低碳排放也可得到重要的化工产品.
①![]() 溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(HCO3-)∶c(CO32-)=2∶1,则所得溶液的pH=__________[常温下
溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(HCO3-)∶c(CO32-)=2∶1,则所得溶液的pH=__________[常温下![]() 、
、![]() ]。
]。
②在清除锅炉水垢的过程中,需要用![]() 将水垢中的
将水垢中的![]() 转化为
转化为![]() ,将微溶的
,将微溶的![]() 难溶性的
难溶性的![]() 的理由是_____________________________________________.
的理由是_____________________________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)

相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。

请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是____________。
②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是__________________________。
(2)步骤Ⅱ,需加入过量H2O2,理由是____(请简述理由,并且写出对应的离子反应方程式)。
(3)步骤Ⅲ,合适的pH范围是____________________。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。请给出上述操作的正确顺序_____________(操作可重复使用)。
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如下图所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择_______方式进行冷却结晶。

A. 快速降温 B. 缓慢降温 C. 变速降温
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=_________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)为加快反应速率,可以采取的措施是_______
a.降低温度
b.增大压强
c.恒容时充入He气
d.恒压时充入He气
e.及时分离NH3
查看答案和解析>>
科目: 来源: 题型:
【题目】贝诺酯是一种新型抗炎、解热、镇痛药,其结构如下所示。下列对该化合物叙述正确的是( )

A. 贝诺酯分子式C17H14O5N
B. 贝诺酯属于芳香烃
C. 贝诺酯属于高分子化合物
D. 已知贝诺酯的水解产物之一为对氨基乙酰酚(![]() ),在核磁共振氢谱中,对氨基乙酰酚有5种峰
),在核磁共振氢谱中,对氨基乙酰酚有5种峰
查看答案和解析>>
科目: 来源: 题型:
【题目】12.0g某液态有机化合物A完全燃烧后,生成14.4g H2O和26.4g CO2。测得有机化合物A的蒸气对H2的相对密度是30,求:
(1)有机物A的分子式_______________________。(写出计算过程)
(2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况):a mL(密度为ρ g/cm3)的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1mol A分子中有x mol氢原子能跟金属钠反应,则x的计算式为____________(可以不化简,写出计算过程)。

(3)已知该有机物能够与金属钠或钾发生反应,并对有机物进行核磁共振操作,发现核磁共振氢谱图上有三组吸收峰,且峰面积之比为6:1:1,请写出该物质的结构简式:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)碳酸镧![]() 可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl3+6NH4HCO3═La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl3+6NH4HCO3═La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。

(1)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→_____→_____→_____→_____→_____;
(2)Y中发生反应的化学反应式为_______________;
(3)X中盛放的试剂是___________,其作用为___________________;
(4)Z中应先通入![]() ,后通入过量的
,后通入过量的![]() ,原因为__________________;
,原因为__________________;
二、氢氧化铈![]() 是一种重要的稀土氢氧化物,它可由氟碳酸铈精矿(主要含
是一种重要的稀土氢氧化物,它可由氟碳酸铈精矿(主要含![]() )经如下流程获得:
)经如下流程获得:

已知:在酸性溶液中![]() 有强氧化性,回答下列问题:
有强氧化性,回答下列问题:
(5)氧化焙烧生成的铈化合物二氧化铈(![]() ),其在酸浸时反应的离子方程式为_________________;
),其在酸浸时反应的离子方程式为_________________;
(6)已知有机物HT能将![]() 从水溶液中萃取出来,该过程可表示为:
从水溶液中萃取出来,该过程可表示为:![]() (水层)+
(水层)+![]() (有机层)
(有机层)![]()
![]() +
+![]() (水层)从平衡角度解释:向
(水层)从平衡角度解释:向![]() (有机层)加入
(有机层)加入![]() 获得较纯的含
获得较纯的含![]() 的水溶液的原因是________________;
的水溶液的原因是________________;
(7)已知298K时,Ksp[Ce(OH)3]=1×10-20,为了使溶液中![]() 沉淀完全,需调节pH至少为________;
沉淀完全,需调节pH至少为________;
(8)取某![]() 产品0.50g,加硫酸溶解后,用
产品0.50g,加硫酸溶解后,用![]() 的
的![]() 溶液滴定至终点(铈被还原成
溶液滴定至终点(铈被还原成![]() ).(已知:
).(已知:![]() 的相对分子质量为208)
的相对分子质量为208)
①![]() 溶液盛放在________(填“酸式”或“碱式”)滴定管中;
溶液盛放在________(填“酸式”或“碱式”)滴定管中;
②根据下表实验数据计算![]() 产品的纯度____________;
产品的纯度____________;
滴定次数 |
| |
滴定前读数 | 滴定后读数 | |
第一次 | 0.50 | 23.60 |
第二次 | 1.00 | 26.30 |
第三次 | 1.20 | 24.10 |
③若用硫酸酸化后改用![]() 的
的![]() 溶液滴定产品从而测定
溶液滴定产品从而测定![]() 产品的纯度,其它操作都正确,则测定的
产品的纯度,其它操作都正确,则测定的![]() 产品的纯度____________(填“偏高”、“偏低”或“无影响”)。
产品的纯度____________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中A、B单质是气体,C、D单质是固体。
(1)写出以下元素的名称:B___;C___。
(2)写出D元素在周期表中的位置___。
(3)用电子式表示C2D的形成过程:___。
(4)写出由B、C两元素所形成的原子个数比为1:1的化合物的的电子式___;属于___(填“离子”或“共价”)化合物,存在的化学键的种类有___;写出它与水反应的化学方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】新泽茉莉醛是一种名贵的香料,合成过程中还能得到一种PC树脂,其合成路线如图。

已知:①RCHO+R′CH2CHO![]()
![]() +H2O
+H2O
②RCHO+HOCH2CH2OH![]()
![]() +H2O
+H2O
③![]() +2ROH
+2ROH +HCl
+HCl
(1)E的含氧官能团名称是_________,E分子中共面原子数目最多为___________。
(2)写出反应①的化学方程式_________________________________。
(3)写出符合下列条件并与化合物E互为同分异构体的有机物结构简式____________。
a.能与浓溴水产生白色沉淀
b.能与![]() 溶液反应产生气体
溶液反应产生气体
c.苯环上一氯代物有两种
(4)反应②的反应类型是_______。
(5)已知甲的相对分子质量为30,写出甲和G的结构简式____________、___________。
(6)已知化合物C的核磁共振氢谱有四种峰,写出反应③的化学方程式______________。
(7)结合已知①,以乙醇和苯甲醛( )为原料,选用必要的无机试剂合成
)为原料,选用必要的无机试剂合成 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)______________________________。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I、依据氧化还原反应:2Ag+(aq)+ Cu(s)== Cu2+(aq)+ 2Ag(s)设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是______;电解质溶液Y是_____。
(2)银电极上发生的电极反应为________; X电极上发生的电极反应为____________。
(3)图中所示连接的盐桥(U型管中装有饱和KNO3溶液)装置,将其放置于电解质溶液中,此时盐桥中的K+移向__________(填“CuSO4溶液”或“Y溶液”),形成闭合回路,构成原电池。
II、如图所示,甲、乙为相互串联的两个电解池。请回答:
(1)甲池若为用电解原理精炼铜的装置,则A电极为________极,电极反应为________。溶液中的c(Cu2+)与电解前相比________(填“变大”、“变小”或“不变”)。

(2)乙池中Fe极电极反应为______________若在乙池中滴入少量酚酞溶液,电解一段时间后,铁极附近呈__________色。
(3)若甲池A极增重12.8 g,则乙池C(石墨)极放出气体在标准状况下的体积为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com