
科目: 来源: 题型:
【题目】某学生利用如图装置对电解质溶液导电性进行实验探究。下列说法中正确的是

A.闭合开关K,电流表指针发生偏转,证明HCl溶液是电解质
B.闭合开关K,向烧杯中加入NaCl固体,由于HCl与NaCl不反应,故电流表指针不发生变化
C.闭合开关K,向溶液中加入少量NaOH固体,电流表示数几乎不变
D.选取相同浓度的硫酸替换0.1mol·L-1的HCl溶液,电流表的示数相同
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用0.1 mol·Lˉ1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是( )

A. HX为弱酸
B. M点c(HX)—c(X-)﹥c(OH-)—c(H+)
C. 将P点和N点的溶液混合,呈酸性
D. 向N点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX)=c(Cl-) >c(X-)
查看答案和解析>>
科目: 来源: 题型:
【题目】断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E:
化学键 | H—H | Cl—Cl | O===O | C—Cl | C—H | O—H | H—Cl |
E/kJ·mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
请回答下列问题:
如图表示某反应的能量变化关系,则此反应为________(填“吸热”或“放热”)反应,其中ΔH=______________(用含有a、b的关系式表示)。

若图示中表示反应 H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则b=________kJ·mol-1,x=__________。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃利用空气中的氧气跟氯化氢反应制氯气。反应的化学方程式为___________________________________。若忽略温度和压强对反应热的影响,根据上题中的有关数据,计算当反应中有1 mol电子转移时,反应的能量变化为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用“银-Ferrozine”法测室内甲醛含量的原理为:

已知:吸光度与溶液中有色物质的浓度成正比
下列说法正确的是
A. 反应①中参与反应的HCHO为30g时转移电子2mol
B. 可用双氧水检验反应②后的溶液中是否存在Fe3+
C. 生成44.8 LCO2时反应②中参加反应的Ag一定为8mol
D. 理论上测得溶液吸光度越高,HCHO含量也越高
查看答案和解析>>
科目: 来源: 题型:
【题目】巧妙的实验设计有助于更好地解决问题。下列装置不能达到实验目的的是
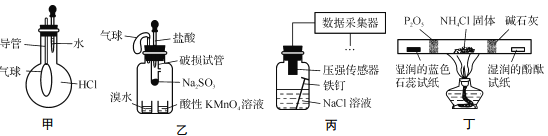
A. 用装置甲验证HCl气体易溶于水
B. 用装置乙验证SO2具有漂白性
C. 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
D. 用装置丁检验NH4Cl分解产生的气体
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用如图所示装量制取少量澳苯并证明该反应是取代反应。请回答:

(1)仪器A的名称为____________,冷凝水的进水口为_________,(填“m”或“n”)。
(2)制取溴苯的化学方程式为___________________。
(3)锥形瓶中足量NaOH溶液的作用是_________。
(4)从实验安全的角度分析,该实验装置存在一处明显的缺陷请指出_________。
(5)反应结束后向三颈瓶中滴加氢氧化钠溶液,充分振荡,然后用__________(填仪器名称)分离出溴苯(仍含有少量苯)。
(6)设计实验证明制取溴苯的反应是取代反应___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
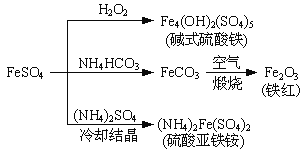
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe、Ni、Pt在周期表中同族,该族元素的化合物在科学研究和实际生产中有许多重要用途。
(1)①Fe在元素周期表中的位置为________。
②已知FeO晶体晶胞结构如NaCl型,Fe2+的价层电子排布式为________,阴离子的配位数为_______。
③K3[Fe(CN)5NO]的组成元素中,属于第二周期元素的电负性由小到大的顺序是_______。
④把氯气通入黄血盐(K4[Fe(CN)6])溶液中,得到赤血盐(K3[Fe(CN)6]),该反应的化学方程式为________。
(2)铂可与不同的配体形成多种配合物。分子式为[Pt(NH3)2Cl4]的配合物的配体是______;该配合物有两种不同的结构,其中呈橙黄色的物质的结构比较不稳定,在水中的溶解度大;呈亮黄色的物质的结构较稳定,在水中的溶解度小,下图图1所示的物质中呈亮黄色的是______(填“A”或“B”),理由是________。

(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如上图图2所示。储氢原理为:镧镍合金吸咐H2,H2解离为H储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱心和上下底面的面心,则形成的储氢化合物的化学式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
氢化反应: ,
,![]()
副反应: ,
,![]()
解聚反应: ,
,![]()
回答下列问题:
(1)反应![]() 的△H= _____ kJ/mol。
的△H= _____ kJ/mol。
(2)一定条件下,将环戊二烯溶于有机溶剂进行氢化反应(不考虑二聚反应),反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如图所示:

①0~4h氢化反应速率比副反应快的可能原因是_________。
②最佳的反应时间为__h。若需迅速减慢甚至停止反应,可采取的措施有____(写一条即可)。
③一段时间后,环戊烯产率快速下降的原因可能是_________。
(3)解聚反应在刚性容器中进行(不考虑氢化反应和副反应)。
①其他条件不变,有利于提高双环戊二烯平衡转化率的是 ____(填标号)。
A.增大双环戊二烯的用量 B.使用催化剂 C.及时分离产物 D.适当提高温度
②实际生产中常通入水蒸气以降低双环戊二烯的温度(水蒸气不参与反应)。某温度下,通入总压为300 kPa的双环戊二烯和水蒸气,达到平衡后总压为500 kPa,双环戊二烯的转化率为80%,则p(H2O)=______kPa,平衡常数Kp=_______kPa (Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钼具有高强度、高熔点、耐磨抗腐性,用于制火箭、卫星的合金构件。钼酸钠晶体(Na2MoO42H2O)是一种重要的金属缓蚀剂。利用钼矿(主要成分MoS2,还含少量钙、镁等元素)为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:
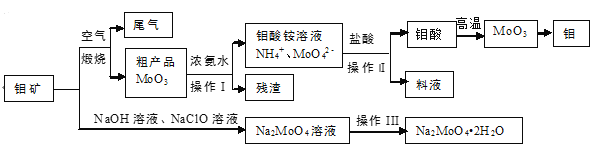
(1)Na2MoO42H2O中钼元素的价态为___,煅烧产生的尾气引起的环境危害主要是_______。
(2)用浓氨水溶解粗产品的离子方程式是_________,由图中信息可以判断MoO3是___氧化物。(填“酸性”、“碱性”或“两性”)
(3)操作I是_____,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是____。
(4)采用 NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。
①请配平以下化学反应:
___NaClO +___MoS2 + ___NaOH →___Na2MoO4 +___Na2SO4 +___NaCl +___H2O。
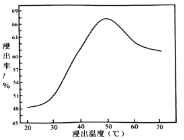
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是______(写一点)。
(5)锂和MoS2可充电电池的工作原理为xLi+nMoS2![]() Lix(MoS2)n,则电池充电时阳极上的电极反应式为______。
Lix(MoS2)n,则电池充电时阳极上的电极反应式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com