
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常用的食品添加剂,使用时需严格控制用量。实验室以2NO+Na2O2=2NaNO2为原理,利用下列装置制取NaNO2(夹持和加热仪器略)。

已知:①酸性KMnO4溶液可将NO及NO2-氧化为NO3-,MnO4-被还原为Mn2+。
②HNO2具有不稳定性:2HNO2=NO2↑+NO↑+H2O。
回答下列问题:
(1)按气流方向连接仪器接口______________(填接口字母)。
(2)实验过程中C装置内观察到的现象是___________________________。
(3)Na2O2充分反应后,测定NaNO2含量:称取反应后B中固体样品3.45g溶于蒸馏水,冷却后用0.50mol· L-1酸性KMnO4标准液滴定。重复三次,标准液平均用量为20.00mL。
①该测定实验需要用到下列仪器中的___________(填序号)。
a.锥形瓶 b.容量瓶 c.胶头滴管 d.酸式滴定管 e.碱式滴定管 f.玻璃棒
②假定其他物质不与KMnO4反应,则固体样品中NaNO2的纯度为____%。
③实验得到NaNO2的含量明显偏低,分析样品中含有的主要杂质为_____(填化学式)。为提高产品含量,对实验装置的改进是在B装置之前加装盛有_____(填药品名称)的______(填仪器名称)。
(4)设计一个实验方案证明酸性条件下NaNO2具有氧化性________________________。
(提供的试剂:0.10mol·L-1NaNO2溶液、KMnO4溶液、0.10mol·L-1KI溶液、淀粉溶液、稀硝酸、稀硫酸)
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表中的28号元素Ni有重要的用途,它有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面也有广泛应用。工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备并精制镍的基本流程如下:

已知:电极电位(E)能体现微粒的氧化还原能力强弱,如:
H2-2e-=2H+ E=0.00V Cu-2e-=Cu2+ E=0.34V
Fe-2e-=Fe2+ E=-0.44V Ni-2e-=Ni2+ E=-0.25V
(1)镍在周期表中的位置为_______________________________。
(2)高镍矿破碎细磨的作用______________________________________。
(3)焰色反应实验可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是______________________。
(4)造渣除铁时发生的化学反应方程式___________________________________(产物以氧化形式表示)。
(5)电解制粗镍时阳极发生的主要电极反应式_____________________________________。
(6)工业上由NiSO4溶液制得Ni(OH)2后,再滴加NaC1O溶液,滴加过程中发生反应的离子方程式为_________________________________________________________。
(7)电解精炼镍的过程需控制pH为2~5,试分析原因______________________________,阳极泥的成分为________________(写名称)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究CO2的综合利用对促进“低碳经济”的发展有重要意义。
(1)工业上以CO2、NH3为原料生产尿素[CO(NH2)2],反应实际为两步进行:
I:2NH3(g)+CO2(g)![]() H2NCOONH4(s) △H1=-272kJ·mol-1
H2NCOONH4(s) △H1=-272kJ·mol-1
II:H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
已知:H2O(l)==H2O(g) △H3=+44kJ·mol-1
①请写出以NH3、CO2为原料,合成尿素和液态水的热化学方程式______________。
②T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,如图是CO2平衡转化率(![]() )与x的关系。求图中A点NH3的平衡转化率
)与x的关系。求图中A点NH3的平衡转化率![]() =________%。
=________%。
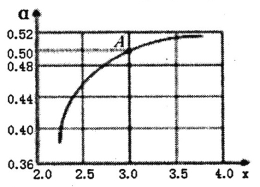
③当x=1.0时,若起始的压强为p0kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=_______(kPa)-3(KP为以分压表示的平衡常数)。
(2)用CO2和H2合成甲醇:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
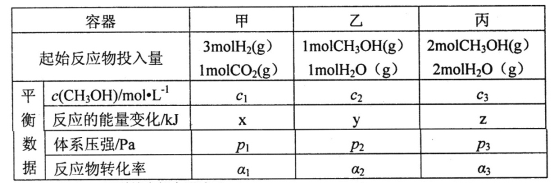
①甲容器10s达到平衡时测得x=39.2,则甲中CO2的平均反应速率____________。
②下列说法正确的是________(填字母编号)。
A.2c1<c3 B.z<2y C.p3>2p2 D.α1+α3>1
(3)用NaOH溶液做碳捕捉剂可获得化工产品Na2CO3。常温下若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=_____[K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11],溶液中c(Na+)_____c(HCO3-)+2c(CO32-)(填“>”“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组在查阅文献及实验探究的基础上,深刻地认识了卤素的性质。
I.F2与C12的相似性。1971年N.H.Studier和E.H.Appelman从冰(-40℃)的氟化作用中首次发现F2、C12与水的反应相似。
(1)写出氟气与水发生上述反应的化学方程式_____________________________________。
II.次氯酸钠和氯酸钾的制备。按图装配仪器并检查装置的气密性。

第一步:在锥形瓶内放约3g MnO2粉末,安全漏斗深入试管底部;
第二步:在管6中放4mL 6mol·L-1KOH溶液(放热水浴中),管7中放4mL 2mol· L-1NaOH溶液(放冰水浴中)。打开控制夹3,关闭控制夹4;
第三步:由漏斗加入15mL 9mol·L-1HC1溶液,缓慢加热,控制氯气均匀产生。热水浴温度控制在323K~328K;
第四步:一段时间后,停止加热,……
(2)锥形瓶中用小试管的优点为_________________________________________________。
(3)停止加热后的操作是____________________________________,再将管6和管7拆下。
(4)查阅文献资料知道,将NaC1O溶液加热,NaC1O分解可生成NaC1O3,据此推断若将KC1O3加热至673K,其分解的化学方程式为_____________________________________。
Ⅲ.C1-、Br-、I-的混合液中C1-的鉴定
已知:Ksp(AgC1)=1.8×10-10 Ksp(AgBr)=5.4×10-13 Ksp(AgI)=8.5×10-17

第一步:取2-3滴C1-、Br-、I-的混合液,加1滴6mol·L-1HNO3溶液酸化,滴加0.1mol·L-1AgNO3溶液至沉淀完全,加热2min,离心分离,弃去溶液:
第二步:在沉淀中加入5~10滴2mol·L-1NH3·H2O溶液,剧烈搅拌,并温热1min,离心沉降,移清液于另一只试管中。
(5)已知![]() ,设平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溶解AgBr沉淀所需氨水的最低浓度约为_______mol·L-1(
,设平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溶解AgBr沉淀所需氨水的最低浓度约为_______mol·L-1(![]() )。
)。
(6)根据上述计算,可推知清液中溶质主要成分的化学式为_________________________。
第三步:清液用6mol·L-1HNO3酸化,
(7)现象是_______________________________________________,证实C1-存在。反应的离子方程式为__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】迷迭香酸是一种天然抗氧化剂,具有较强的抗氧化活性,能有效降低癌症和动脉硬化的风险。其结构简式为:
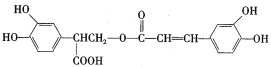
合成路线如下:
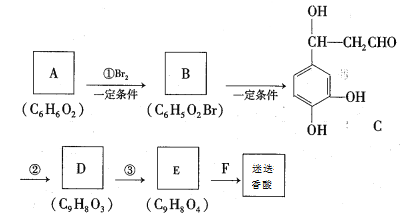
根据题意回答下列问题:
(1)A的结构简式为____________。
(2)①、②的反应类型分别是_____________、_____________。
(3)E的结构简式为__________________
(4)F在一定条件下发生缩聚反应的化学方程式为__________________________________
(5)写出一种与C互为同分异构体,且同时满足下列条件的有机的结构简式________________
①苯环上的一氯代物有2种
②1 mol该有机物能与1 molNaHCO3反应
③能与浓溴水反应,1 mol该有机物消耗3 mol Br2
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组在实验室研究溶剂对溴乙烷与氢氧化钠反应的影响,请回答下列问题:
实验1:将溴乙烷与适量NaOH水溶液混合,加热。
(1)检验Br﹣:取反应后所得___层液体(填“上”或“下”),向其中加入________(填试剂),观察到有淡黄色沉淀生成。
(2)检验乙醇:用__________________(填波谱名称)检验生成物中有乙醇,由此可知该反应类型为_____________。
实验2:将溴乙烷与适量NaOH乙醇溶液混合,加热。
(3)检验乙烯:将反应产生的气体通入右侧试管中,观察到溶液褪色,试剂X是_____________
(4)写出溴乙烷与NaOH乙醇溶液反应的化学方程式_________________
实验结论:
(5)由实验1、2得出的结论是_______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物环丁基甲酸(H)是一种应用广泛的有机物,合成化合物H的路线如图:
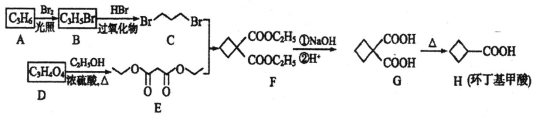
(1)A属于烯烃,其结构简式为______________,由A→B的反应类型是___________。
(2)D中官能团的名称是_________________,由D→E的反应类型是________________。
(3)E的名称是_______________。
(4)写出F与NaOH溶液反应的化学方程式_______________________。
(5)M是G的同分异构体,且满足以下条件:①能使溴的四氯化碳溶液褪色;②1mol M与足量饱和NaHCO3反应产生88g气体;③核磁共振氢谱为2组峰;则M的结构简式为(不考虑立体异构,只写一种)________________,N是比M少一个碳原子的同系物,则N的同分异构体有_________种。
(6)参照上述合成路线,以![]() 和化合物E为原料(无机试剂任选),设计制备
和化合物E为原料(无机试剂任选),设计制备![]() 的合成路线________________________________。
的合成路线________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,体积都为V0mL、浓度都为0.1mol·L-1的MC1、NaR、MR三种盐溶液,加入蒸馏水稀释至VmL,溶液的pH与1g(V/V0)的关系如图所示。下列说法不正确的是

A. 曲线X代表NaR溶液,其中c(OH-)=c(H+)+c(HR)
B. 曲线Y中任何两点,水的电离程度都相同
C. 将等体积等物质的量浓度的MC1和NaR溶液混合后,c(M+)=c(R-)
D. 常温下,HR的电离常数Ka≈1×10-5
查看答案和解析>>
科目: 来源: 题型:
【题目】制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶化合物FeCl3+6H2O===FeCl3·6H2O。

(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):
①接_______________________________________________________
(2)烧瓶A发生的反应中,氧化剂是________(填物质名称),B中反应的化学方程式是___________________。
(3)容器D的作用是_____________________________________________,容器E的作用是__________________________________________________。
(4)A、B中的酒精灯应先点燃________处(填“A”或“B”)的酒精灯,理由是___________________。
(5)这套实验装置是否完整?________(填“是”或“否”),若不完整,还须补充________装置(若第一问填“是”,则此问不需要作答)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com