
科目: 来源: 题型:
【题目】氧化铬(Cr2O3)主要用于冶炼金属铬、有机化学合成的催化剂等.工业上是以铬铁矿[主要成份为Fe(CrO2)2,还含有Al2O3、SiO2等杂质]为主要原料进行生产,其主要工艺流程如下:

(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)焙烧时的主要反应为:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,其中被氧化的元素为___,每产生32g Fe2O3,转移电子的物质的量为_______,该步骤不能使用陶瓷容器,原因是_______。
8Na2CrO4+2Fe2O3+8CO2,其中被氧化的元素为___,每产生32g Fe2O3,转移电子的物质的量为_______,该步骤不能使用陶瓷容器,原因是_______。
(3)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作:__________。
(4)硫磺在与铬酸钠的反应中转化为硫代硫酸钠,反应的离子方程式为___________,滤渣中除Al(OH)3外还有_______(填化学式)。
(5)某工厂用448 kg铬铁矿粉[含Fe(CrO2)280%]制备Cr2O3,最终得到产品182.4 kg,产率为______。
(6)Cr3+也有一定毒性,会污染水体,常温下要除去废液中多余的Cr3+,调节pH至少为_______,才能使铬离子沉淀完全 (已知:离子浓度小于1×10-5mol/L时沉淀就达完全, Cr(OH)3的Ksp=1.0×10-32)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知以下信息:①1 mol N2的共价键断裂吸收946 kJ的能量;1 mol H2的共价键断裂吸收436 kJ的能量;形成1 mol NH3中的化学键释放1 173 kJ的能量。②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
N2(mol·L-1) | H2(mol·L-1) | NH3(mol·L-1) | |
起始时 | 3 | 3 | 0 |
2s末 | 2.6 | 1.8 | 0.8 |
根据以上相关数据回答问题:
(1)用H2表示该反应2 s内的平均反应速率为________
(2)______(填“能”或“不能”)确认该反应2 s末已达化学平衡状态。
(3)写出该反应的化学方程式:
________________________________________________________________________。
(4)氮气和氢气生成氨气的过程______(填“释放”或“吸收”)能量。
查看答案和解析>>
科目: 来源: 题型:
【题目】在两个绝热恒容的密闭容器中分别进行下列两个可逆反应:
甲:C(s)+H2O(g) ![]() CO(g)+H2(g);
CO(g)+H2(g);
乙:CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:
①混合气体平均相对分子质量不再改变
②气体的总物质的量不再改变
③各气体组成浓度相等
④反应体系中温度保持不变
⑤断裂氢氧键速率是断裂氢氢键速率的2倍
⑥混合气体密度不变
其中能表明甲、乙容器中反应都达到平衡状态的是
A. ①③B. ④⑤C. ③④D. ②⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.在常温下,下列四种溶液:①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4
④0.1mol/L NH3H2O,请根据要求填写下列空白:
(1)溶液①呈__ 性(填“酸”、“碱”或“中”),其原因是_______(用离子方程式表示)。
(2)在上述四种溶液中,pH最小的是________。
(3)比较四种溶液中c(NH4+)的由大到小的顺序是______________(填序号)。
(4)四种溶液中,离子浓度为0.1 mol/L的是___________(填离子符号)。
(5)将③和④等体积混合,溶液中的离子浓度由大到小的顺序为_____________。
Ⅱ. KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作如下所述:称取稍多于所需要的KMnO4固体溶于水中,将溶液加热并保持微沸1h;用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;过滤得到的KMnO4溶液贮存于棕色试剂瓶中并放在暗处;利用氧化还原反应滴定法,在70~80℃条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度.
请回答下列问题:
(1)准确量取一定体积的KMnO4溶液需要使用的仪器是_____________。
(2)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用________(填字母)。
A.H2C2O4 2H2O B.FeSO4 C.浓盐酸 D.Na2SO3
(3)若准确称取Wg(2)中所选的基准试剂溶于水配成500mL溶液,配制溶液时,所用仪器除烧杯和玻璃棒外,还有________________。取25.00mL置于锥形瓶中,用KMnO4溶液滴定至终点,消耗KMnO4溶液VmL.KMnO4溶液的物质的量浓度为____________mol/L。
(4)若用放置两周的KMnO4标准溶液去测定水样中的Fe2+的含量,测得的浓度值将____________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z
2Z
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 升高温度平衡常数增大,则此反应为吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷是非常重要的能源和化工原料,请回答下列问题.
(1)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为H2SO4溶液),通过装置Ⅱ实现铁棒镀铜。

①a处应通入______(填“CH4”或“O2”),b处电极上发生的电极反应式是___________;
②电镀结束后,装置Ⅰ中溶液的pH______(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度_______;
③若实验过程中Ⅱ中的铜片质量减少了2.56g,则Ⅰ中理论上消耗CH4的体积(标准状况)______L。
(2)若将装置Ⅱ中的两电极均改为石墨惰性电极:
①写出装置Ⅱ中发生的总化学反应方式________________________________。
②若用Ⅱ电解200 mL 0.05 mol·L-1的CuSO4溶液,一段时间后溶液中的Cu2+恰好完全析出,恢复至室温,溶液pH=__________(忽略电解过程中溶液体积变化);若想将上述电解后的溶液恢复为与电解前的溶液相同,可以加入一定质量的__________(填序号);
a.Cu b.CuO c.Cu(OH)2 d.CuSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol,
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ/mol,
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为______________________________________________________。
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
CH3OH(g)+H2O(g)。某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
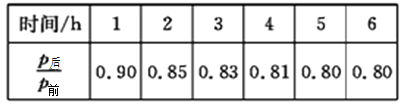
①用H2表示的前2h的平均反应速率v(H2)=_________。
②该温度下,CO2的平衡转化率为______________。
(3)在300℃、8MPa下,将CO2和H2按物质的量之比1:3通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)的关系。
C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)的关系。
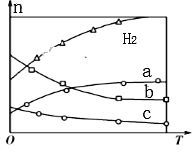
①该反应的△H_______0(填“>”或“<”)。
②曲线c表示的物质为______(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在容积为1L的容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,则下列表述中正确的是( )

A.该反应的化学方程式为2M![]() N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,可逆反应2A(g)![]() B(g)+3C(g),反应处于平衡状态的是( )
B(g)+3C(g),反应处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | v(A)=2mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
B | v(A)=2mol·L-1·min-1 | v(C)=2mol·L-1·min-1 |
C | v(A)=1mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
D | v(A)=1mol·L-1·min-1 | v(C)=1.5mol·L-1·min-1 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,符合这一情况的是( )
a极板 | b极板 | a电极 | Z溶液 | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 正极 | CuCl2 |

A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com