
科目: 来源: 题型:
【题目】元素X形成的气态X2的分子共有三种,其相对分子质量依次为158、160、162,此三种分子的物质的量之比为9:6:1,据此,下列说法中正确的是( )
A.X有三种同位素
B.其中一种同位素的质量数为80
C.X2的平均相对分子质量为159
D.质量数为79的同位素的原子百分数为50%
查看答案和解析>>
科目: 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 |
HClO | 3×10-8 |
H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 |
H2S | K1=1.3×10-7 K2=7.1×10-15 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是____。
(2)常温下0.1 mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母)。
A.c(H+) B.![]() C.
C.![]() D.c(OH-)
D.c(OH-)
(3)0.1 mol/L的H2C2O4溶液与0.1mol/L的KOH的溶液等体积混合后所得溶液中各离子浓度由大到小的顺序为__________________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK________NaClO (填“>”、“<”或“=”)。
(5)向0.1mol/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=______________。
(6)向NaClO溶液中通入少量的CO2,所发生的离子方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化亚铜(CuH)是-种难溶的物质,可用CuSO4溶液和“另一种物质”在40C~50C时反应来制备,CuH不稳定,它既能与HCl反应产生气体,又能在氯气中燃烧,以下有关判断不正确的是 ( )
A. CuH既可做氧化剂又可做还原剂
B. 另一种物质一定具有还原性
C. CuH跟HCl反应的化学方程式为:2CuH+2HCl=CuCl2+2H2↑+Cu
D. CuH在Cl2燃烧的化学方程式为:CuH+Cl2 ![]() CuCl+HCl
CuCl+HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。X与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。下列说法中正确的是

A.原子半径:W > Z > Y > X
B.气态氢化物热稳定性:Y > Z > W
C.元素Z和W均存在两种以上的含氧酸
D.元素Z和W在自然界中均只能以化合态存在
查看答案和解析>>
科目: 来源: 题型:
【题目】用无水Na2CO3固体配制230mL0.1000mol·L-1的溶液。请回答:
(1)在配制过程中不必要的玻璃仪器是___。
A.烧杯 B.量筒C.玻璃棒 D.胶头滴管 E.容量瓶
(2)定容时的操作:当液面接近容量瓶刻度线时,__,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(3)下列操作会使配得的Na2CO3溶液浓度偏低的是___。
A.称取相同质量的Na2CO3·10H2O固体进行配制
B.定容时俯视容量瓶的刻度线
C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 碳酸钙跟醋酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
B. 硫酸铝溶液中加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH![]()
C. 向足量的溴化亚铁溶液中通入少量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D. 碳酸氢钠溶液与足量的氢氧化钡溶液混合:Ba2++2OH-+2HCO![]() =BaCO3↓+CO
=BaCO3↓+CO![]() +2H2O
+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,向某VL的密闭容器中充入3molH2(g)和3molI2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) △H=-26.5kJmol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。请回答下列问题:
2HI(g) △H=-26.5kJmol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。请回答下列问题:

(1)0-5秒内平均反应速率v(HI)=___mol/(Ls)。
(2)该反应达到平衡状态时,放出的热量为___kJ。
(3)判断该反应达到平衡的依据是___(填序号)。
①H2消耗的速率和I2消耗的速率相等
②H2、I2、HI的浓度比为1:1:2
③H2、I2、HI的浓度都不再发生变化
④该条件下正、逆反应速率都为零
⑤混合气体的平均分子量不再发生变化
⑥气体的颜色不再发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验装置图的叙述中,正确的是

① ②
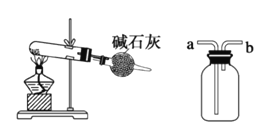
③ ④
A. 装置①:常用于分离互不相溶的液体混合物
B. 装置②:可用于吸收氯化氢、氨气等气体尾气,防止倒吸
C. 装置③:可用于实验室以氯化铵为原料制备少量NH3的实验
D. 装置④:先装满水,再从b口进NO气体,可收集NO
查看答案和解析>>
科目: 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易水解、受热易分解的白色固体,某研究小组用下图所示的实验装置制备氨基甲酸铵,反应原理为:2NH3(g)+CO2(g)=H2NCOONH4(s) △H<0。

(1)仪器B的名称是________________。
(2)打开阀门K,装置E中由固体药品所产生的气体就立即进入装置D,则该固体药品的名称为________________。
(3)装置D为制备氨基甲酸铵的反应器(CCl4充当惰性介质),在合适催化剂下搅拌一段时间。
①反应在冰水浴中进行的原因为_______________________________________。
②当CCl4液体中产生较多晶体悬浮物时,即停止反应,__________(填操作名称)分离得到粗产品。
(4)仪器G的作用有:_______________________________________。
(5)该实验装置中有一处不足,改进方法是______________________________________。
(6)已知氨基甲酸铵可完全水解为碳酸氢铵,则该反应的化学方程式_________________。
(7)为测定某样品中氨基甲酸铵的质量分数,某研究小组用该样品进行实验,已知杂质不参与反应,请补充完整测定某样品中氨基甲酸铵质量分数的实验方案(限选试剂:蒸馏水、澄清石灰水、Ba(OH)2溶液):用天平称取一定质量的样品,加水溶解,____________________,测量的数据取平均值进行计算。
查看答案和解析>>
科目: 来源: 题型:
【题目】锰元素在多个领域中均有重要应用,回答下列问题。
(1)Mn在元素周期表中位于_____区;MnSO4中阳离子的价电子排布式为__________;
(2)Mn3+在水溶液中容易歧化为MnO2和Mn2+下列说法合理的是_______
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+产内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(3)在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为_____。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为__________
(4)二价锰的化合物的性质如下表所示:
物质 | MCl2 | MnS | MnSO4 |
熔点 | 650℃ | 1610℃ | 700℃ |
上表三种物质中晶格能最大的是________;上表涉及的三种阴离子中,半径最大的是______。
(5)某锰氧化物的晶胞结构如下图所示:

该锰的氧化物的化学式为______________,该晶体中Mn的配位数为____________,该晶体中Mn之间的最近距离为____________pm(用a、b来表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com