
科目: 来源: 题型:
【题目】在0.1 mol·L-1氨水中存在如下电离平衡:NH3·H2O ![]() NH4++OH-,对于该平衡,下列叙述正确的是
NH4++OH-,对于该平衡,下列叙述正确的是
A. 加入水时,溶液中c(OH-) 增大
B. 加入少量NH4Cl固体,平衡向逆方向移动,电离平衡常数减小
C. 通入少量HCl气体,溶液中c(NH4+)增大
D. 降低温度,促进NH3·H2O电离
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目: 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 已知![]()
![]() ,则
,则![]() 固体与稀盐酸完全反应,放出的热量即为
固体与稀盐酸完全反应,放出的热量即为![]()
B. 已知![]()
![]()
![]()
![]() 则
则![]()
C. 已知![]() ,则反应物总能量小于生成物总能量
,则反应物总能量小于生成物总能量
D. 已知![]() (白磷,s)=
(白磷,s)=![]() (红磷,s)
(红磷,s)![]() ,则白磷比红磷稳定
,则白磷比红磷稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br-
B.SO42-
C.H2SO3
D.NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的重要反应:4NH3+5O2![]() 4NO+6H2O,对于该反应判断正确的是( )
4NO+6H2O,对于该反应判断正确的是( )
A.氨气是氧化剂
B.该反应是置换反应
C.氧气被还原
D.若有17g氨参加反应,反应中转移10mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠的生产过程如图:

已知:Na2FeO4中在碱性环境中稳定存在。
请回答以下问题:
(1)Na2FeO4中铁元素的化合价为__;下列标志中应贴在盛装Na2FeO4容器上的是__。

(2)菱铁矿粉碎的目的是__,写出“碱浸”过程中SiO2所发生反应的化学方程式为__。
(3)操作1与操作2的实验名称均为____,步骤③的目的是将Fe2+氧化成Fe3-,其离子方程式为___。
(4)高铁酸钠消毒后的还原产物具有净水作用,解释净水原理为__。
(5)已知4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2↑,将一定量的Na2FeO4投入到pH不同的工业污水中(污水中其余成分均相同),测得溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示。试分析曲线Ⅰ比曲线Ⅱ对应的污水pH__(填“高”或“低”)。
4Fe(OH)3+8OH-+3O2↑,将一定量的Na2FeO4投入到pH不同的工业污水中(污水中其余成分均相同),测得溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示。试分析曲线Ⅰ比曲线Ⅱ对应的污水pH__(填“高”或“低”)。

查看答案和解析>>
科目: 来源: 题型:
【题目】关于氯气与过氧化钠在加热条件下的反应,在网上有三种不同的观点:
①氯气和过氧化钠均为强氧化剂,两者不反应。
②能反应,氯气是氧化剂。
③能反应,过氧化钠是氧化剂。为鉴别上述观点的真伪,进行了如下探究实验:

回答下列问题:
(1)过氧化钠的电子式为________,甲装置中发生反应的离子反应方程式为___。
(2)仪器戊的名称为___,其作用为___。
(3)为完成上述实验目的,仪器口连接顺序为a__。如果缺少丙装置, 乙装置中发生的反应为____。
(4)实验结束后,为验证观点②是否正确,需进一步进行的实验操作为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】从本质入手看物质及其能量的变化,可以让我们更加深入的去理解所学知识的内涵及外延应用。对于《原电池》这部分知识也是如此,如图是原电池的基本构造模型:

(1)若a和b的电极材料为Al或Mg。
①若c为稀NaOH溶液时,则a的电极材料为__,该极电极方程式为___。
②若c为稀H2SO4时,则a的电极材料为___,该极电极方程式为__。
(2)对于原电池的应用,以下说法正确的是__。
A.选择构成原电池两极材料时,必须选择活泼性不同的两种金属材料
B.构成原电池时,负极材料的活泼性一定比正极材料的强
C.构成原电池时,作为负极材料的金属受到保护
D.从能量转化角度去看,如图的氧化还原反应能量变化曲线,则不能够设计原电池

查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实可以证明一水合氨是弱电解质的是
①室温下,![]() 的氨水可以使酚酞试液变红②室温下,
的氨水可以使酚酞试液变红②室温下,![]() 的氯化铵溶液的PH约为5
的氯化铵溶液的PH约为5
③在相同条件下,氨水溶液的导电性比强碱溶液弱④铵盐受热易分解
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:(填“加快”、“不变”或“减慢”)。
Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:(填“加快”、“不变”或“减慢”)。
①保持体积不变充入Ne,其反应速率___。
②保持压强不变充入Ne,其反应速率____。
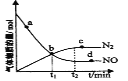
(2)在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为__(选填字母)。
5N2(g)+6H2O(g)。某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为__(选填字母)。
(3)一定条件下,在2L密闭容器内,发生反应2NO2(g)![]() N2O4(g),n(NO2)随时间变化如下表:
N2O4(g),n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
①用NO2表示0~2s内该反应的平均速率为___。
②在第5s时,NO2的转化率为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com