
科目: 来源: 题型:
【题目】如图是实验室制备氯气并验证氯气性质的装置(其中夹持装置已省略)。
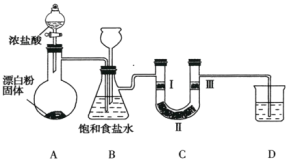
已知:装置A是氯气的发生装置,反应的化学方程式为![]() 。
。
据此回答下列问题:
(1)装置B中饱和食盐水的作用是_________。
(2)装置B也是安全瓶,目的是监测实验进行时装置C中是否发生堵塞,请写出装置C中发生堵塞时装置B中的实验现象:__________________。
(3)装置C的作用是验证氯气是否具有漂白性,则装置C中I、Ⅱ、Ⅲ处依次应放入的物质是___________(填字母)。
序号 | I | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)装置D的作用是_____________________________。
(5)如果将20mL、10mol·L-1的浓盐酸与足量次氯酸钙充分反应,实际能收集到的氯气在标准状况下的体积将__________。
A.≥2.24 L B.>2.24 L C.≤2.24 L D.<2.24 L
查看答案和解析>>
科目: 来源: 题型:
【题目】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作____剂。
(2)自然界Cr主要以+3价和+6价存在。Cr2O72-的Cr能引起细胞的突变,在酸性条件下可以用亚硫酸钠将其还原为+3价的铬,写出其离子方程式_____________________________________________ :
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是______________。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:

①上述操作中有多次过滤,其中玻璃棒的作用__________ ,向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为____。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是____。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔 前景。
前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJmol1,
2H2(g)+O2(g)═2H2O(g) △H=484kJmol1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________________________________________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g)![]() CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
①A,B两点对应的压强大小关系是PA________PB(填“>,<,=”)
②下列叙述能说明上述反应能达到化学平衡状态的是___________(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.气体的平均相对分子质量和压强不再改变
③在P1压强、T1°C时,该反应的平衡常数K=_________(填计算结果)
④T1°C、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol, H2 :0.2mol, CH3OH:0.2mol。此时v正 ________ v逆(填> 、 < 或 =)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是_______________________ 。
(2)A的化学式为_____________________,D的化学式为_____________________,D溶液显碱性的原因是(用离子方程式表示):__________________________。
(3)E和氨水反应的离子方程式是________________________________。E与D反应的离子方程式是__________。
(4)设计实验检验B中所含的阳离子:_____________________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组想制取CuO并证明CuO能加快KClO3的分解速率,设计并进行如下实验:
(一)制取CuO
①称取2 g胆矾研细后放入烧杯,加适量蒸馏水溶解;
②向步骤①所得溶液中逐滴加入NaOH溶液至铜离子沉淀完全;
③将步骤②所得沉淀过滤、洗涤,灼烧至恒重,研细备用。
回答下列问题:
(1)上述实验步骤中溶解、过滤时玻璃棒的作用依次是_____________。
(2)步骤③中灼烧前后,沉淀颜色的变化为_______。
(3)利用化学方法证明铜离子已经沉淀完全的操作是____________。
(二)证明CuO能加快KClO3的分解速率,并与MnO2的催化效率进行比较
用下图装置进行实验,且均以生成相同状况下20 mL氧气为准,其它可能影响实验的因素均已忽略,相关数据见下表:

实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
① | 1.5 g | 无其他物质 | |
② | 1.5 g | CuO 0.5 g | |
③ | 1.5 g | MnO2 0.5 g |
(4)上述实验中的待测数据指_____________;该实验除以上思路外,还可以通过测定______________来比较CuO和MnO2的催化效率。
(5)本实验装置图中量气装置由乳胶管和仪器A_______________(填名称)及50 mL___________(填“酸式”或“碱式”)滴定管改造后组装而成;
(6)为探究CuO在实验②中是否起催化作用,需补做如下实验:
a.CuO的质量有没有改变;
b.CuO的化学性质有没有改变。
简述验证CuO质量是否改变的操作过程_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是

A. X、Y两端都必须用铁作电极
B. 不可以用NaOH溶液作为电解液
C. 阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH-
D. X端为电解池的阳极
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积和物质的量浓度均相同的两份Ba(OH)2溶液中,分别滴入等物质的量浓度的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图A、B所示。(忽略温度和体积变化)

(1)曲线B表示滴加的溶液为_________。
(2)d点溶液导电性最弱的原因为__________;ac段发生反应的离子方程式为___________。
(3)曲线A中b点溶液的pH_______曲线B中b点溶液的pH(填“大于”、“小于”或“等于” );a点和c点加入溶液的体积比为_________。
(4)向NaHSO4溶液中滴加Ba(OH)2溶液至溶液恰好呈中性,继续滴加Ba(OH)2溶液时发生反应的离子方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的Fe、Fe2O3和CuO的混合物,放入体积为100 mL物质的量浓度为2.2 mol/L的H2SO4溶液中,充分反应后,生成气体896mL(标准状况),得到不溶固体1.28 g。过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为100mL)。向滤液中加入2 mol/L NaOH溶液至40mL时开始出现沉淀。则未滴加NaOH溶液前滤液中FeSO4的物质的量浓度为
A. 1.8 mol/LB. 2 mol/LC. 2.2 mol/LD. 无法计算
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列叙述正确的是
A. 14 g乙烯与丙烯的混合气体中所含氢原子数目为2NA ; 18 g H2O与18 g D2O所含电子数均为10NA
B. 56 g铁片投入足量浓H2SO4中生成NA个SO2分子;密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
C. 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA ;0.1molCl2溶于足量水中,转移的电子数小于0.1NA
D. 25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA ;1 L 0.1 mol·L-1的Na2CO3溶液中所含氧原子数目为0.3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】写出如下化学反应方程式,如果是离子反应,则写离子反应方程式:
(1)氯气通入石灰乳中制取漂白粉:_________________________________
(2)漂白粉生效:_________________________________
(3)饱和的碳酸钠溶液中通入二氧化碳:_________________________________
(4)过氧化钠与二氧化碳反应:_________________________________
(5)次氯酸见光分解:_________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com