
科目: 来源: 题型:
【题目】下图是实验室制备溴乙烷的装置(已知溴乙烷的沸点38.4℃)。步骤如下:
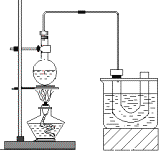
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇(密度为0.789g/cm3)、28mL78%浓硫酸,然后加入研细的23g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
已知:NaBr+H2SO4=HBr+NaHSO4
请回答下列问题:
(1)写出烧瓶中制备溴乙烷的化学方程式___________________________________。
(2)在大烧杯加入冰水的作用是____________________________________。溴乙烷的水溶性小于乙醇的水溶性,其原因是_________________________。反应一段时间后,U型管内可观察到的现象是___________________________。
(3)反应时若温度过高会有副反应发生,写出发生有机副反应的化学方程式________。(任写一个)
(4)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质,最好选择下列试剂中的__________(填序号)
A.H2O B.CCl4 C.Na2SO3溶液 D.NaOH溶液
除杂所需的主要玻璃仪器是__________________(填仪器名称)。要进一步制得纯净的溴乙烷,可再用水洗,然后加入无水CaCl2,再进行_________________(填操作名称)。
(5)最后制得溴乙烷产品14.2g,求上述实验中溴乙烷的产率为____________
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)下列关于烷烃的表述正确的是
A. 乙烷的结构式为CH3CH3
B. C5H12分子的某种结构为![]()
C. ![]() 与
与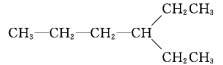 互为同分异构体
互为同分异构体
D. C4 H10的一氯代物有4种
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
科目: 来源: 题型:
【题目】(12分)已知某溶液中存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为________(选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;若上述关系中④是正确的,则溶液中的溶质为________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)________c(OH-)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:在一定条件下,可以发生R—CH![]() CH2+HX
CH2+HX![]()
A、B、C、D、E有如下转化关系:
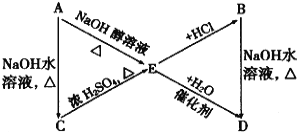
其中A、B分别是化学式为C3H7Cl的两种同分异构体。根据图中各物质的转化关系,填写下列空白:
(1) B的结构简式:_________________________
(2) 完成下列反应的化学方程式:
①A→C__________________________________________________________________;
②E→D__________________________________________________________________;
Ⅱ.从樟科植物枝叶提取的精油中其中含有下列甲、乙两种成分:

(1)乙中含有的官能团的名称为______________________(不包括苯环)。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
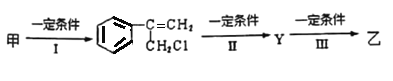
①反应I的反应类型是________________________;反应II的条件是_________________;
②反应III的化学方程式为__________________________________(不需注明反应条件)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为实验室制取乙炔并验证其性质的装置图。下列说法不合理的是

A. 将生成的气体直接通入到溴水中,溴水褪色,说明有乙炔生成
B. 酸性KMnO4溶液褪色,说明乙炔具有还原性
C. 逐滴加入饱和食盐水可控制生成乙炔的速率
D. 将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用N2和H2可以实现合成氨气,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列有关问题:
(1)已知N2(g)+O2(g)=2NO(g) ΔH =+180.5kJ·mol-1,N2(g)+3H2(g)![]() 2NH3(g) ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为___________。
2NH3(g) ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为___________。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g),其化学平衡常数K与温度t的关系如下表:
2NH3(g),其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1×106 | K1 | K2 | ...... |
完成下列问题:
①比较K1、K2的大小:K1______K2(填“>”、“=”或“<”);
②在恒温恒压下判断该反应达到化学平衡状态的依据是______(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)硝酸工业的尾气NO可用于制备NH4NO3,其工作原理如图。
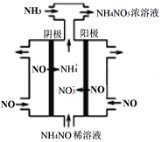
①其阴极的电极反应式为___________。
②常温下,1L pH=6的NH4NO3溶液中c(NH3·H2O)+c(OH-)=________mol·L-1。
(4)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2,反应达到平衡时,c(NH3)=0.5mol·L-1,c(CO2)=0.25mol·L-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。再次平衡后,平衡常数为______。
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2,反应达到平衡时,c(NH3)=0.5mol·L-1,c(CO2)=0.25mol·L-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。再次平衡后,平衡常数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如表为某有机物与各种试剂的反应现象,则这种有机物可能是
试剂 | 钠 | 溴水 | NaHCO3溶液 |
现象 | 放出气体 | 褪色 | 放出气体 |
A. CH2═CH﹣CH2﹣OHB. ![]()
C. CH2═CH﹣COOHD. CH3COOH
查看答案和解析>>
科目: 来源: 题型:
【题目】在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )

A. X是电源的负极
B. 阴极的反应式是:H2O+2eˉ=H2+O2ˉCO2+2eˉ=CO+O2ˉ
C. 总反应可表示为:H2O+CO2H2+CO+O2
D. 阴、阳两极生成的气体的物质的量之比是1︰1
查看答案和解析>>
科目: 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq),下列说法错误的是 ( )
CuS(s)+Mn2+(aq),下列说法错误的是 ( )
A. 相同条件下,MnS的Ksp比CuS的Ksp大
B. 该反应的平衡常数K=![]()
C. 该反应达到平衡时c(Mn2+)=c(Cu2+)
D. 往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com