
科目: 来源: 题型:
【题目】实验室常用质量分数为36.5%的盐酸(密度为1.20g/㎝3)配制480mL1.0mol/LHCl。回答下列问题:
(1)此浓盐酸的物质的量浓度是________________
(2)配制时,必要的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、____________________。该试验中两次用到玻璃棒,其作用分别是 ___________________,________________________。
(3)若实验遇下列情况,溶液的浓度偏高的是 __________________________________________
A.量取浓盐酸时仰视量筒刻度
B.摇匀后发现液面低于刻度线,滴加蒸馏水至刻度线再摇匀
C.定容时俯视容量瓶的刻度线
D.容量瓶内壁附有水珠而未干燥处理
E.未冷却到室温就定容
(4)若取50.0mL上述已配好的溶液,与另一150mL0.2mol/L的HCl溶液混合,最后得到的溶液的物质的量浓度为_________________(设溶液的体积变化可忽略)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛酸钡是一种强介电化合物材料,具有高介电常数和低介电损耗,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”,工业制取方法如图,先获得不溶性草酸氧钛钡晶体BaTiO(C2O4)2·4H2O,煅烧后可获得钛酸钡粉体。下列说法不正确的是( )
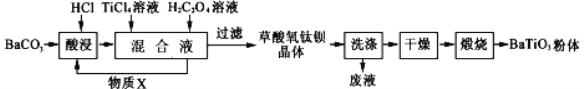
A. 酸浸时发生的反应的离子方程式为:BaCO3+2H+== CO2↑+Ba2++H2O
B. 加入H2C2O4溶液时,发生反应的化学方程式为:BaCl2+2H2C2O4+TiCl4+5H2O=BaTiO(C2O4)2·4H2O↓+6HCl
C. 可循环使用的物质X是CO2
D. 煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气体产物有CO、CO2和H2O(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在标准状况时,8.96L的容器里所含CO的质量为11.2g,则一氧化碳的摩尔质量为____________ g/mol ;
(2)3.01×1023个OH-的物质的量是 __________ mol,质量为_____g,其质子数为________(用NA表示),电子数为 ___________(用NA表示);
(3)同温同压下同体积的H2和A气体的质量分别是0.2 g和1.6 g,则气体A的相对分子质量为________,含有A的分子个数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,现有 0.1 mol·L-1的 NH4HCO3 溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与 pH 的关系如下图所示。下列说法正确的是
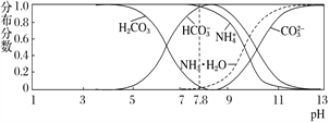
A. 当溶液的 pH=9 时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3 ·H2O)>c(CO32-)
B. NH4HCO3 溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3)
C. 往该溶液中逐滴滴加氢氧化钠时,NH4+和 HCO3-浓度均逐渐减小
D. 通过分析可知常温下 Kb(NH3·H2O)大于 Ka1(H2CO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:
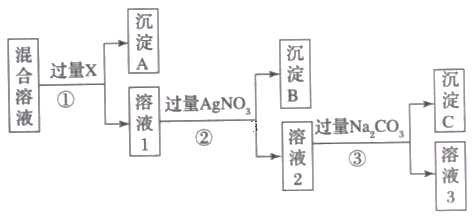
请回答下列问题:
(1)试剂X最好是 ___________________(填化学式),检验X是否加入过量的方法是____________。
(2)写出步骤②反应的离子方程式:_______________________________________ 。写出步骤③反应的离子方程式:____________________________________________ 。
(3)按此实验方案得到的溶液3中肯定含有____________(填化学式,下同)杂质;为了除去该杂质,可以向溶液3中加入过量的____________,之后若要获得纯NaNO3固体,还需进行的实验操作是_______________________________(填操作名称)。
查看答案和解析>>
科目: 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
B. 由实验数据可知该反应较适宜的温度为T1
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出下图中序号①~④仪器的名称:
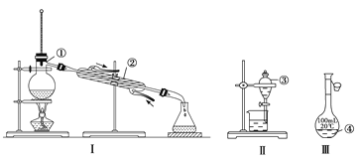
①_____________;②__________; ③_____________; ④____________。
(2)仪器①~④中,使用时必须检查是否漏水的有__________(填仪器序号)。
(3)如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL 1 mol·L-l的稀硫酸。

可供选用的仪器有: ①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。请回答下列问题:
①配制稀硫酸时,还缺少的仪器有____________、___________(写仪器名称)。
②经计算,配制480 mL l mol·L-l的稀硫酸需要用量筒量取上述浓硫酸的体积为_______mL。
③在转入容量瓶前烧杯中液体应____________,否则会使结果浓度___________(填“偏高”“偏低”或“无影响”)。
④定容时必须使溶液的凹液面与刻度线相平,若俯视会使浓度_________。(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl3是中学实验室常用的试剂,可以用来制备氢氧化铁胶体。
(1)下列制备氢氧化铁胶体的操作方法正确的是____________(填字母);
a.向饱和氯化铁溶液中滴加少量的氢氧化钠稀溶液
b.加热煮沸氯化铁饱和溶液
c.![]() 氨水中滴加氯化铁浓溶液
氨水中滴加氯化铁浓溶液
d.在沸水中滴加饱和氯化铁溶液,煮沸至液体呈红褐色
(2)写出制备氢氧化铁胶体的离子方程式__________________________;
(3)下列与胶体性质无关的是_____________(填字母);
a.河流入海口处形成沙洲
b.使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
c.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
d.在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀
e.冶金厂常用高压电除去烟尘
(4)从溶液中分离提纯Fe(OH)3胶体的方法叫_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在下列反应中,HCl作还原剂的是________,HCl作氧化剂的是________。
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓) ![]() PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
④KClO3+6HCl(浓) ![]() KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
⑤CuO+2HCl=CuCl2+H2O
(2)用“双线桥法”标明以下反应中电子转移的方向和数目________,若反应中有3.01×1023个电子转移,则被氧化的还原剂的物质的量为___________。2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某双原子分子构成的气体,其摩尔质量为M g·mol-1,阿伏加德罗常数为NA。对质量为m g的该气体,求:(用含M、NA、m符号的式子表示)。
(1)在标准状况下,该气体的体积为________L,密度为________g·L-1。
(2)该气体所含的原子总数为________个。
(3)该气体的一个分子的质量约为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com