
科目: 来源: 题型:
【题目】一种离子晶体的晶胞如图所示。其中阳离子A以![]() 表示,阴离子B以
表示,阴离子B以![]() 表示。关于该离子晶体的说法正确的是( )
表示。关于该离子晶体的说法正确的是( )
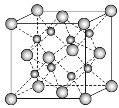
A. 阳离子的配位数为8,化学式为AB
B. 阴离子的配位数为4,化学式为A2B
C. 每个晶胞中含4个A
D. 每个A周围有4个与它等距且最近的A
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语的表达正确的是( )
A. 原子核内有10个中子的氧原子:![]() O
O
B. 氯原子的结构示意图:![]()
C. Fe3+的最外层电子排布式:3s23p63d5
D. 基态铜原子的外围电子轨道表示式:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2常温下是深红棕色液体),设计了如下流程图:
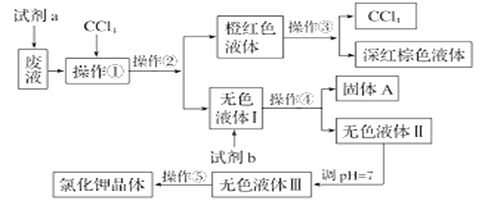
请根据流程图,回答相关问题:
(1)若试剂a为H2O2溶液(H+),已知氧化性:H2O2>Br2
①写出废液中的某阴离子和a发生反应的离子方程式为:__________________________;
②每消耗0.2mol H2O2,反应转移的电子为______mol;
(2)为了除去无色液体I中的Ca2+、Mg2+、SO42-,试剂b可选择:KOH、BaCl2、K2CO3溶液,其添加顺序不正确的是(_______)
A、KOH、BaCl2、K2CO3 B、BaCl2、KOH、K2CO3
C、BaCl2、K2CO3 、KOH D、KOH、K2CO3 、BaCl2
(3)用盐酸调pH=7(中性)是为了除去杂质离子___和___,以提高氯化钾晶体的纯度;
(4)操作①②③④⑤对应的名称分别是:____、分液、_____、过滤、______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
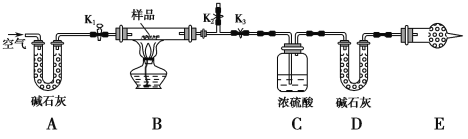
(1) 实验步骤:
① 按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是____________________。
② 称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是___________________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为___________________________、______________________________。
⑤ 打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2) 关于该实验方案,请回答下列问题。
① E处干燥管中盛放的药品是________,其作用是______________________________________,如果实验中没有该装置,则可能导致测量结果NaHCO3的质量分数________(填“偏大”“偏小”或“无影响”)。
② 若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为__________________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】⑴ 三月万物复苏,很多人会外出踏青旅游。
①自驾游出行方便。制造汽车轮胎的主要材料是____(填字母)。
a.铝合金 b.橡胶 c.玻璃
②高速列车出行快捷。建设铁路需要大量水泥。工业上生产水泥的主要原料是石灰石和____(填字母)。
a.黏土 b.纯碱 c.石英
③轮船出行舒适。为防止轮船钢板被腐蚀,可在钢板上镶嵌____(填字母)。
a.铜块 b.锡块 c.锌块
⑵ 旅游期间,在娱乐、购物、旅游时要讲究文明、保护环境。
用过的聚乙烯塑料食品袋要投入贴有可回收物标志的垃圾箱中。聚乙烯的结构简式是______。
⑶在外出行要注意饮食健康。
①面包、牛奶是常见的食物之一,牛奶中的蛋白质在人体内水解可生成______________。
②橙汁是常用饮品。某品牌橙汁中含有维生素C、白砂糖、精制盐、柠檬黄和苯甲酸钠等成分,这几种物质中属于着色剂的是______________。
③饮食不当会引起胃痛。胃舒平[主要成分是Al(OH)3]可治疗胃酸过多,写出Al(OH)3与胃酸反应的离子方程式________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的个数是( )
①过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
②5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
③Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色;
④3mol单质铁完全转化为Fe3O4,失去8NA个电子
⑤标准状态下,2.24L CH3CH2OH中质子数为3.4NA
⑥将100mL 0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
⑦区别NaHCO3与Na2CO3溶液,可用Ca(OH)2溶液
A.3B.4C.5D.6
查看答案和解析>>
科目: 来源: 题型:
【题目】下列为元素周期表的一部分、表中阿拉伯数字(1、2……)是元素周期表中行或列的序号,请参照元素A~I在表中的位置,回答下列问题。
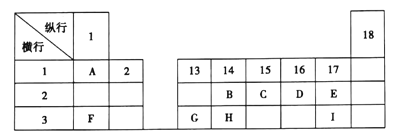
(1)B、C、H三元素中非金属性最强的是__________(写出元素符号)。
(2)表中某元素能形成两性氧化物,写出该氧化物的化学式___________。
(3)D与F构成原子个数比为1:1和1:2的两种离子化合物Z和M,写出Z与H2O反应的化学方程式_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某校研究性学习小组的学生欲制取、收集氨气,并探究氨气的有关性质,请你参与回答实验中的有关问题。
①要收集较纯的干燥氨气,使用的方法是__________________________。
②甲、乙两小组的学生用相同容积的圆底烧瓶各收集一瓶干燥氨气,进行实验.结果都产生了喷泉,说明氨气______溶于水;圆底烧瓶中溶液变红色,说明有_____性物质生成。
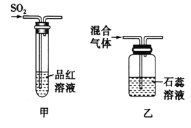
(2)某兴趣小组为验证SO2和Cl2的漂白性,设计了如下方案,请你参与回答下列问题(尾气处理装置未画出)_____。
①如图甲所示,向品红溶液中通入SO2,同学们发现品红溶液褪色了,停止通气体,加热试管,发现溶液又变为红色,说明SO2的漂白是__________(填“可恢复的”或“不可恢复的”)。
②如图乙所示,将干燥的Cl2和SO2按其体积比1:1混合,通入石蕊溶液中,发现石蕊溶液变红,不褪色,试用化学方程式解释之:_____________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A. 氢氧化钠与盐酸;氢氧化钠与醋酸
B. Na2CO3溶液与盐酸;CaCO3与盐酸
C. BaCl2溶液与Na2SO4溶液;BaCl2溶液与NaHSO4溶液
D. Fe(OH)3胶体的制备;Fe(OH)3沉淀的制备
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )。
A. 根据反应Cu+H2SO4![]() CuSO4+H2↑可推知Cu的还原性比H2的强
CuSO4+H2↑可推知Cu的还原性比H2的强
B. 在反应CaH2+2H2O===Ca(OH)2+2H2↑中,水作氧化剂
C. 反应3NO2+H2O===2HNO3+NO中氧化剂和还原剂的物质的量之比是3∶1
D. Cl2的氧化性强于I2的氧化性,故置换反应I2+2NaClO3===2NaIO3+Cl2不能发生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com