
科目: 来源: 题型:
【题目】下列表述不正确的是
A | B | C | D |
|
|
|
|
盐桥中的Cl-移向AgNO3溶液 | a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 | 纯铜的电极反应式为:Cu2++2e-=Cu | 正极反应式为: O2+2H2O+4e-=4OH- |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种杀菌效率高、二次污染小的水处理剂。实验室可以通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2+K2SO4+2CO2+2H2O,
(1)双线桥表示氧化还原,线桥上标明得失电子、发生的反应。_______
(2)若1mo KClO3参加反应时有_______mol电子转移。
(3)若生成标准状况下的CO2的体积是44.8L,则参加反应的还原剂的物质的量是多少mol?(要求有规范的过程)_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用图装置制取氯气,并进行相关性质的实验。
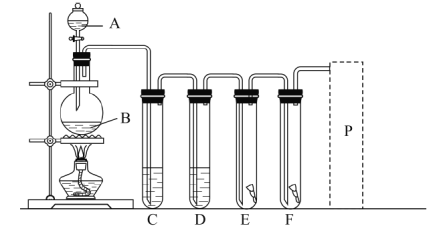
(1)A、B两仪器的名称:A________、B________。
(2)写出实验室用此装置制取氯气的化学方程式________。
(3)为了得到纯净干燥的氯气,写出装置C、D中应该加入的药品的名称:C____、D_________。
(4)E中放入红色干布条,F中放入红色湿布条。可观察到的现象是________,写出发生反应的化学方程式________。
(5)P处为尾气处理装置,画出装置图,标出所用的药品。________

(6)NaClO是“84”消毒液的有效成分。请回答下列问题。
①NaClO中Cl元素的化合价是______。
②用氢氧化钠溶液和氯气反应制备“84”消毒液,反应的离子方程式是_______。
③若将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是_________。
(7)FeCl3在现代工业中应用广泛,某化学研究性学习小组模拟工业生产流程制备无水FeCl3。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华,无水CaCl2是常用的干燥剂。他们设计了制备无水FeCl3的实验方案,装置示意如图(加热、加持及尾气处理装置略去)及操作步骤如下:
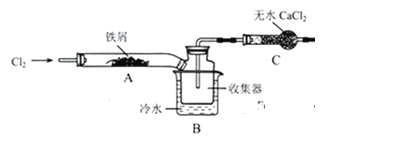
①检查装置气密性
②通入干燥的氯气,赶尽装置内的空气
③用酒精灯在铁屑下方加热至反应完成
④……
⑤体系冷却后,停止通入氯气,并用干燥的的氮气赶尽氯气,将收集器密封。
请回答下列问题:
①装置A中发生反应的化学方程式_____________。
②步骤③加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积的FeCl3进入收集器,第④步操作是________。
③操作步骤中,为防止潮解所采取的措施有(填步骤序号)________。
④装置B中的冷却水作用为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钠及其化合物有非常重要的用途。
(1)钠的化学性质非常活泼。画出钠的原子结构示意图________。
钠与水反应的实验过程如图①、②、③所示。
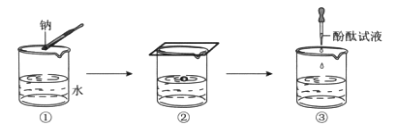
①将图②中的现象与解释用直线连接起来。_________
实验现象 解释
钠熔成小球 产生了气体
钠四处游动,嘶嘶作响 钠的密度比水小
钠浮在水面上 钠与水反应放热且钠的熔点低
②在③中酚酞变红,说明溶液呈_______(填“酸”或“碱”或“中”)性。
③钠与水反应的化学方程式是_________。
(2)过氧化钠可在潜水艇中作为氧气的来源。写出过氧化钠与水反应的化学方程式___,与二氧化碳反应的化学方程式___。
(3)为探究Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验:
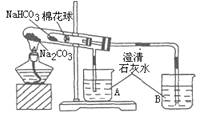
加热一段时间后,________(填“A”或“B”)中澄清石灰水变浑浊,写出澄清石灰水变浑浊的离子方程式:________。写出试管中发生反应的化学方程式________。
(4)我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。含有氮元素、钾元素、磷元素的某些盐可以作为化肥。
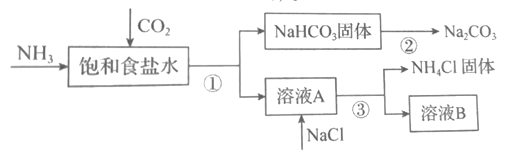
①联合制碱法所制得的“碱”是指_______(填化学式)。
②在①-③所涉及的操作方法中,包含过滤的是_______(填序号)。
③根据图,将化学方程式补充完整:NH3+CO2+___+___=NaHCO3↓+NH4Cl
④NaHCO3溶于水电离的方程式___。
⑤下列说法中,正确的是___(填字母)
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH4+、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
Ⅰ.(1)下列措施中可以使0.10mol·L-1 CH3COOH溶液的电离程度增大的是__________(填序号)。
a.加入少量0.10mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)__________V(醋酸)(填">" "<"或“=”)。
(3)某温度下,Kw=1×10-12,将 0.02mol·L-1 的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH =__________。
Ⅱ.实验表明,液态时纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也显著强于纯水。又知液态纯酸都像水那样进行自身电离(H2O+H2O![]() H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
(1)纯硫酸在液态时自身电离的方程式是__________
(2)25℃时,液态纯硫酸的离子积常数K(H2SO4)__________(填“>”“<”或“=”)1×10-14
(3)在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是__________.
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向25mL 0.1mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是( )
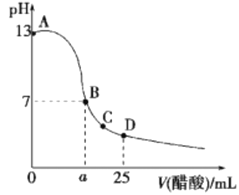
A. 在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. ![]()
C. C点对应的溶液中,水电离出的H+浓度大于10-7mol·L-1
D. D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH) =2c(H+) -c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)2SO3(g) △H<0的影响如图所示,下列说法正确的是( )
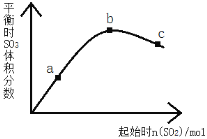
A. 反应b、c点均为平衡点,a点未达平衡且向正反应方向进行
B. a、b、c三点中,a点时SO2的转化率最高
C. 上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高
D. a、b、c三点的平衡常数Kb>Kc>Ka
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,属于氧化还原反应的是
A.CaCO3+2HCl=CaCl2+H2O+CO2↑
B.CaO+H2O=Ca(OH)2
C.WO3+3H2![]() W+3H2O
W+3H2O
D.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置。
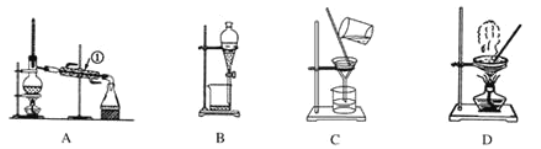
利用以上装置,可以按以下实验方案从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。(已知甲苯和甲醇均为有机溶剂,有机物大多能互溶)
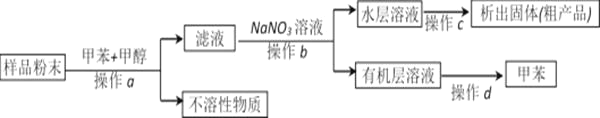
(1)装置A中仪器①的冷却水下进上出的目的是________________________________,使用装置A的操作是__________(填“a”、“b”、“c”或“d”,下同)。
(2)使用装置B的操作是_______(填“a”、“b”、“c”或“d”),使用分液漏斗前应该先_________。
(3)装置C的玻璃棒作用是___________,若所得沉淀不溶于水且需要洗涤,则洗涤的具体操作是________________________________________________________________________________。
(4)使用装置D的操作是_________(填“a”、“b”、“c”或“d”),该操作中玻璃棒的作用是_____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),已知其中一种化合物的化学式为KCuCl3,下列有关说法中错误的是( )
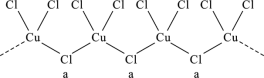
A. a位置上Cl原子的杂化轨道类型为sp3
B. 另一种的化学式为K2CuCl3
C. 铜元素在周期表中位于d区
D. 该物质中存在配位键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com