
科目: 来源: 题型:
【题目】如图所示向A中充入1 mol X 、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,
V(A) = V(B) = a L。在相同温度和有催化剂存在下,两容器中各自发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g) ΔH<0。达到平衡时,V(A) = 1.1a L。(连通管中气体体积不计)下列说法正确的是( )
2Z(g)+W(g) ΔH<0。达到平衡时,V(A) = 1.1a L。(连通管中气体体积不计)下列说法正确的是( )
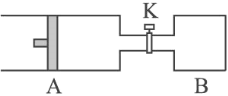
A. n(Z)B = 2n(Z)A
B. A容器中X的转化率为20%
C. 若向A和B中均再加入1molX和1molY,X的体积分数均增大
D. 打开K保持温度不变,又达到平衡时,A的体积为3.3a L
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E为短周期元素且原子序数依次増大,质子数之和为40。B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E的最高价氧化物的水化物呈两性。
(1)B元素在周期表中的位置为_______。
(2)由A、C、D三种元素组成的化合物的电子式为_______。
(3)废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。現改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,试写出反应的化学方程式______。
(4)若BA3与C2可形成燃料电池,电解质为KOH溶液,则负极的电极反应式为______。(氧化产物不污染环境)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,现有0.1mol·L-1NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是
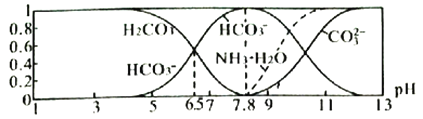
A. 当pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-)
B. NH4HCO3溶液中存在下列关系:![]() <1
<1
C. 向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D. 分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是

A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的c(H+)约为0.1molL-1
B.电池工作时,盐桥中的K+移向甲烧杯
C.电池工作时,外电路的电子方向是从a到b
D.乙池中的氧化产物为SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】在FeCl3和CuCl2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中FeCl3与CuCl2的物质的量浓度之比为

A. 3∶1 B. 1∶2 C. 2∶1 D. 1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构。下列有关辛酸的叙述正确的是

A. 辛酸的同分异构体中能水解生成乙醇的酯类同分异构体共有8种
B. 辛酸的同分异构体(CH3)3CCH(CH3)CH2COOH的名称为2,2,3——三甲基戊酸
C. 辛酸和油酸(C17H33COOH)都是一元羧酸,故二者属于同系物
D. 1mol辛酸与足量的Na反应产生11.2LH2
查看答案和解析>>
科目: 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是

A. 简单离子半径:X>Y>Z>W
B. X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
C. 气态氢化物的稳定性:Z>W>Y
D. Y元素存在同素异形体
查看答案和解析>>
科目: 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数与压强变化的关系如图所示,则下列叙述正确的是( )
pC(g) △H<0,在一定温度下,平衡时B的体积分数与压强变化的关系如图所示,则下列叙述正确的是( )

①m+n<p ②x点的状态是v正>v逆 ③n>p ④x点比y点的反应速度慢 ⑤若升高温度,该反应的平衡常数增大
A. ①②④ B. ②④
C. ③⑤ D. ①③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)向NaHSO4溶液中滴加NaHSO3溶液的离子反应方程式为:_____,若是改加氢氧化钡溶液至中性,离子反应方程式为:______。
(2)向1L 1mol/L的NH4Al(SO4)2溶液中滴加2.25L 等浓度的Ba(OH)2溶液,离子反应方程式为:__。
(3)向含FeI2和FeBr2各1mol 的混合液中通入氯气2.5 mol,离子反应方程式为:____。
(4)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO3-还原为N2。上述反应的离子方程式为___。
(5)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为____。
(6) Fe的一种含氧酸根FeO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3 (g) △H<0,在某一时间段中反应速率与反应过程的曲线关系如图,t1、t3、t4时刻外界条件有所改变。下列说法正确的是( )
2NH3 (g) △H<0,在某一时间段中反应速率与反应过程的曲线关系如图,t1、t3、t4时刻外界条件有所改变。下列说法正确的是( )

A. t5~t6时氨气的体积分数最大 B. t3时升高了温度
C. t1时加入催化剂 D. t4时减小压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com