
科目: 来源: 题型:
【题目】某实验小组设计如下实验装置(图中夹持装置省略)测定制备的CaCO3粉末的纯度(样品中杂质不与酸反应,反应前装置中的CO2已全部排出)。下列说法错误的是
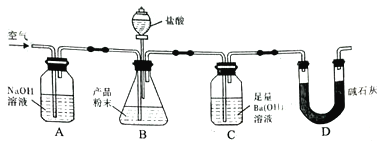
A. 缓入空气的作用是将反应结束后装置中残留的CO2全部鼓入到C装置中被吸收
B. A装置和D装置都是为了防止空气中的CO2气体进入C 装置而产生误差
C. 为了防止B 中盐酸挥发产生干扰,必须在B、C装置中间加一个装有饱和碳酸氢钠溶液的洗气瓶
D. 若CaCO3样品的质量为x,从C 中取出的沉淀洗净干燥后的质量为y,则CaCO3的纯度为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是
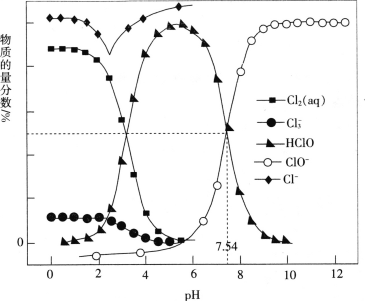
A.pH=1的氯水中,c(Cl2)>c(Cl3-)>c(HClO)>c(ClO-)
B.氯水中的Cl2、ClO-、HClO均能与K2S发生反应
C.已知常温下反应Cl2(aq)+Cl-(aq)![]() Cl3- (aq)的K=0.191,当pH增大时,K减小
Cl3- (aq)的K=0.191,当pH增大时,K减小
D.该温度下,HClO![]() H++ClO-的电离常数Ka=10-7.54
H++ClO-的电离常数Ka=10-7.54
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列气体:H2、Cl2、CH4、HCl、NH3、NO、H2S、SO2,用如图装置进行实验,填写下列空白:

(1)当烧瓶干燥时,从A口进气可收集的气体是___________,从B口进气可收集的气体是___________。
(2)当烧瓶中充满水时,可用来测___________等气体的体积。
(3)可用启普发生器制取的气体有___________
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+KOH![]() C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
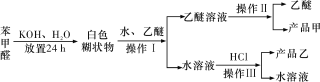
根据以上信息判断,下列说法错误的是
A. 操作Ⅰ是萃取分液
B. 操作Ⅱ蒸馏得到的产品甲是苯甲醇
C. 操作Ⅲ过滤得到的产品乙是苯甲酸钾
D. 乙醚溶液中所溶解的主要成分是苯甲醇
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在一固定容积的密闭容器中发生反应CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
①K的表达式为__________;
②该反应的正反应为__________反应(填“吸热”或“放热”);
③下列选项中,能判断该反应已经达到化学平衡状态的是______(填字母代号)。
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(2)下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa
⑥NH4Cl,其水溶液呈碱性的有________(填序号);常温下,0.01 mol/L HCl溶液的pH=________;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=________。
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
①若向该溶液中滴加NaOH溶液,则先沉淀的是__________(填离子符号);
②判断Ksp[Fe(OH)2]________Ksp[Mg(OH)2](填“>”“=”或“<”)。
(4)某电解装置如图所示。
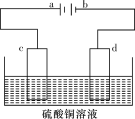
①当用惰性电极电解时,d电极的反应式为________________;
②若用此装置进行铁上镀铜,已知镀层金属采用纯铜且电镀前两电极材料质量相等,电镀一段时间后对电极进行称量,发现两极质量差为16 g,则电路中转移的电子的物质的量为________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,q是Y的单质且为淡黄色固体,n是元素Z的单质,常温下是黄绿色的气体,0.01mol·L–1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法一定正确的是
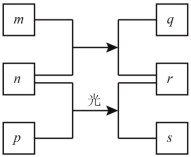
A.原子半径的大小:W<X<Y<Z
B.元素的非金属性:X>Y
C.简单氢化物的稳定性:Z>Y>X
D.氧化物的对应水化物的酸性:Z>Y
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程。

下列有关说法正确的是
A.制取NaHCO3的反应是先往精盐溶液中通入CO2,再通入NH3
B.氯碱工业在阳极产生使湿润淀粉碘化钾试纸变蓝的气体
C.可直接加热MgCl2·6H2O制备无水MgCl2
D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH值增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质:①Ar ②Na2O2 ③AlCl3 ④HClO ⑤N2 ⑥MgF2 ⑦NH4Cl
(1)只存在共价键的是___,不存在化学键的是_____,离子化合物有_______
(2)由离子键和极性键构成的物质是__________
(3)N2的电子式为_____ HClO的电子式为________NH4Cl的电子式为___________
(4)用电子式表示MgF2的形成过程___________
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋约占地球表面积的71%,具有巨大的开发潜力。
Ⅰ.海水淡化的方法主要有蒸馏法、电渗析法和离子交换法等。下图所示为海水蒸馏原理示意图,请回答下列问题:
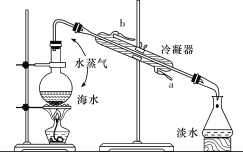
(1)冷却水的出水口是________(填“a”或“b”);
(2)碎瓷片的作用是__________。
Ⅱ.目前,从海水提取的溴占世界溴年产量的三分之一左右,空气吹出法是工业大规模海水提溴的常用方法。其中一种工艺流程为:
①海水浓缩,酸化;
②通入Cl2,使Br-转化为Br2;
③通入空气、水蒸气,将Br2吹入吸收塔,与吸收剂SO2反应转化为HBr;
④通入Cl2,再经过一系列处理得到产品Br2。
请回答下列问题:
(1)步骤②③的目的是_____________(填“富集溴”或“萃取溴”);
(2)在步骤③中,反应生成HBr的化学方程式___________________________________________;
(3)在步骤②中,若通入44.8 L Cl2(标准状况),理论上可得到Br2___________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】按照要求填空:
(1)![]() 在一可变的容积的密闭容器中进行
在一可变的容积的密闭容器中进行
①增加Fe的量,其反应速率的变化是______(填增大、不变、减小,以下相同)
②将容器的体积缩小一半,反应速率______________
③保持体积不变,充入N2使体系压强增大,其反应速率________
④保持压强不变,充入N2使容器的体积增大,其反应速率__________
(2)2HI(g) H2(g)+I2(g)(正反应为吸热反应)改变下列条件:
①减小容器体积:平衡____(填正移,逆移,不移动,以下相同)颜色___(加深,变浅,不变,以下相同)
②加热升高温度:平衡____________
③体积不变,充入H2:平衡_____________颜色_______________
(3)可逆反应2NO2(g) ![]() N2O4(g),(正反应为放热反应),据图判断t2、t3时刻采取的措施t2:____t3:_______
N2O4(g),(正反应为放热反应),据图判断t2、t3时刻采取的措施t2:____t3:_______

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com