
科目: 来源: 题型:
【题目】下列有关一定物质的量浓度的溶液配制的过程中,造成所得的溶液浓度偏大的是
A.要配制100 mL 1 mol·L-1 NaOH溶液,在白纸上称4 g NaOH固体,并且称量速度较慢
B.定容时俯视容量瓶刻度线
C.溶解或稀释溶质时烧杯尚未干燥
D.定容时盖上瓶盖,摇匀后发现液面低于刻度线,再继续滴加蒸馏水使液面重新达到刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示。
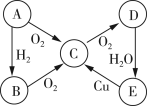
(1)如果A是淡黄色固体,回答下列问题。
①写出A、E的化学式:A________、E________。
②C→D的化学方程式为____________。
③将足量的物质C通入BaCl2溶液中,下列说法正确的是________(填字母序号)。
a.溶液中出现白色沉淀
b.溶液没有明显变化
c.若继续通入Cl2或NH3,则溶液中均出现白色沉淀
(2)如果A是无色气体,回答下列问题。
①D→E的化学方程式为_______。
②E→C的离子方程式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。
(1)他们设计如图实验装置,请你参与探究,并回答问题:
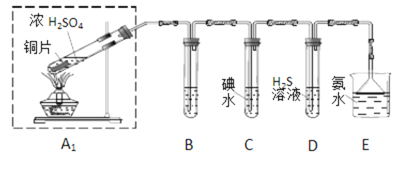
①装置B用于检验SO2的漂白性,其中所盛试剂为______,装置D用于检验SO2的________性质,该装置中反应的化学方程式为_________________________;
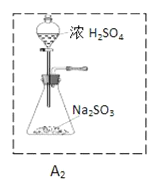
②为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写两点)_____________、____________;
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)。

①你认为哪个装置可行(填序号)_______,使用你所选用的装置测定SO2含量时,还需要测定的物理量是__________________;
②你认为哪个装置不可行(填序号)____,说明理由_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN度液为主要原料制备黄血盐的流程如下:
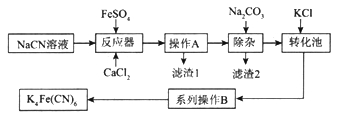
请回答下列问题:
(1)常温下,HCN的电离常数Ka=6.2×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是__________________________。
②浓度均为0.5mol/L的NaCN和HCN的混合溶液显______(填“酸”“碱”或“中”)性,通过计算说明:_________________________。
(2)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:__________。
(3)系列操作B为_____________________。
(4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗可溶性盐Tl2SO4中毒,得到K2SO4及另外一种复杂难溶物,试写出上述治疗Tl2SO4中毒的离子方程式:______________________。
(5)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。
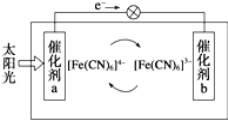
①K+移向催化剂___________(填“a”或“b”)。
②催化剂a表面发生的反应为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下几个方案:
方案I取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度

(1)乙中发生反应的方程式为____________。
(2)仪器接口的连接顺序为(装置可以重复使用)a___________,丁的作用是__________。
(3)当样品充分反应完后,缓慢通入空气的目的是:____________。
方案Ⅱ①称取碱式碳酸镁样品mg;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g/。
(4)下列仪器中,该方案不会用到的是____________。

(5)判断样品完全分解的方法是_______;本实验至少需要称量_______次。
(6)有同学认为方案Ⅱ高温煅烧的过程中会发生MgCO3 +SiO2![]() MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol·L-1·min-1。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol·L-1·min-1。求:
(1)5 min后B的浓度c(B)=________mol·L-1,反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol。
(2)A的平均反应速率:v(A)=________mol·L-1·min-1。
(3)x的值为________。
(4)下列叙述能表明该反应已达平衡状态的是_________(填序号)。
①A的物质的量浓度不变
②3v正(A)=v逆(B)
③混合气体总物质的量不变
④反应物和生成物同时存在,反应体系中四种物质的物质的量均相等
查看答案和解析>>
科目: 来源: 题型:
【题目】酚酯的合成方法之一是由酚与酰卤(![]() )反应制得。
)反应制得。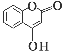 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
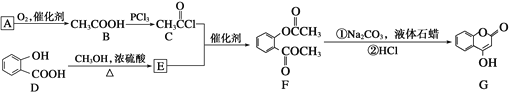
(1)A与银氨溶液反应有银镜生成,则A的结构简式是_________。
(2)B→C的反应类型是_________。
(3)E的结构简式是__________________。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:__________。
(5)下列关于G的说法不正确的是________(填序号)。
a.能与溴单质反应 b.能与金属钠反应
c.1 mol G最多能和3 mol氢气反应 d.分子式是C9H6O3
(6)写出符合下列要求的D的所有同分异构体的结构简式_____。
①遇FeCl3溶液发生显色反应;
②能发生银镜反应
③最多能消耗3molNaOH。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、硫、碳的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:
(1)根据A对应的化合价和物质类别,A为___________(写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的化合物有____________。
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择________,反应的离子方程式为______________。
(3)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题:

①写出制取SO2的化学方程式:_______________。
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为_____。
A. 品红溶液 B. 酸性高锰酸钾溶液 C. 双氧水(H2O2)
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式_______。
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2吸收Br2反应的化学方程式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:
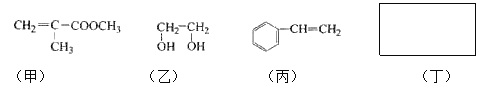
填写下列空白:
(1)甲中不含氧原子的官能团是____________;下列试剂能与甲反应而褪色的是___________(填标号)
a. Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:_______
(3)淀粉通过下列转化可以得到乙(其中A—D均为有机物):

A的分子式是___________,试剂X可以是___________。
(4)已知: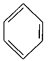 +RCl
+RCl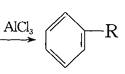 +HCl(-R为烃基)
+HCl(-R为烃基)
 +H2
+H2
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 ______________ 。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为 ___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如右图所示,则8分钟内CO的平均反应速率v(CO)=______。

(2)写出该反应平衡常表达式:K=__________;下列措施中能使该反应的平衡常数K增大的是____(填序号)。
A.升高温度 B.增大压强 C.充入CO D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将______ (填“增大”、“减小”、“不变”)。
(4)铁的重要化合物在生产生活中应用十分广泛。
①高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为____________。
②高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述错误的是____(填序号)。
A.放电时每转移6mol电子,负极有2mol K2FeO4被还原
B.充电时阴极反应为:Zn(OH)2 +2e-=Zn+ 2OH-
C.放电时正极反应为:FeO42-+ 3e-+ 4H2O= Fe(OH)3+ 5OH-
D.充电时阳极附近溶液的碱性减弱
(5)已知:2CO(g)+O2(g)= 2CO2(g) △H=-566 kJ/mol
2H2(g)+ O2(g)= 2H2O(g);△H=-483.6 kJ/mol
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com