
科目: 来源: 题型:
【题目】两种烃的衍生物A和B,所含碳、氢、氧的质量比均为6∶1∶4。完全燃烧0.1 mol A能生成3.6 g水。B只含一个醛基,1.1g B与足量银氨溶液反应,可析出2.7 g Ag。则下列关于物质A和物质B的判断正确的是
A. 物质A一定是乙醛
B. 物质A和物质B互为同分异构体
C. 物质B的同分异构体中既含有醛基又含有羟基的有6种
D. 物质B属于酯类的同分异构体有4种
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:
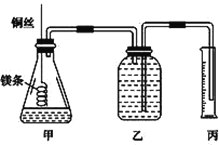
主要操作步骤如下:
①配制一定体积1.0 mol/L的盐酸溶液;
②量取10.0 mL 1.0 mol/L的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请回答下列问题。
(1)为使HCl全部参加反应,a的数值至少为___________;若实验中至少需要220mL上述盐酸,配制该盐酸溶液需量取36.5% 1.18g/cm3的浓盐酸______mL。
(2)在配制溶液中,以下操作会使溶液浓度偏低的是_______(填序号)
A、在溶解过程中有少量液体溅出烧杯外 B、定容时仰视刻度线
C、量取浓盐酸时仰视刻度线 D、容量瓶洗净后没有干燥直接配制
(3)实验步骤⑤中应选用________(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(4)若忽略水蒸气的影响,读数时除恢复到室温外,还要注意_____________________。在实验条件下测得气体摩尔体积的计算式为Vm=________(用含V的表达式表示),若未除去镁条表面的氧化膜,则测量结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400-500℃和常压下的催化氧化: 2SO2 + O2![]() 2SO3, 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述相关说法中错误的是
2SO3, 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述相关说法中错误的是
A.反应温度选择400-500℃是该反应催化剂的催化活性、反应速率、反应限度等角度综合考虑的结果
B.因为在常压下该反应的速率和SO2的转化率已经很高了,所以选择常压条件主要是从生产成本角度考虑
C.为提高SO2的转化率,应适当提高O2的浓度
D.使用催化剂是为了加快反应速率,提高SO3产率
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①铅蓄电池总反应为: Pb(s) + PbO2(s) + 2H2SO4(aq) ![]() 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)
②电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
下列关于电池的叙述正确的是
A.充电电池的化学反应原理是氧化还原反应
B.铅蓄电池可以无限制地反复放电、充电,不会造成环境污染
C.铅蓄电池比锂电池的理论比能量高
D.铅蓄电池正极电极反应为:PbO2 +4H+ +2e— = Pb2+ +2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法错误的是
A.食物中的营养物质主要包括:糖类、油脂、蛋白质、维生素、无机盐和水
B.燃烧相同体积的管道煤气(主要成分CO和H2)和天然气,管道煤气消耗氧气体积大
C.油脂没有固定的熔沸点,是食物中产生能量最高的营养物质
D.金属钠和碳酸钠溶液都可以用来区分乙醇、乙酸和苯
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是________(填元素符号)。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是________,其氢化物的电子式是_________。
(3)元素①和②可以形成多种化合物。下图模型表示的分子中,不可能由①和②形成的是_______(填序号)。
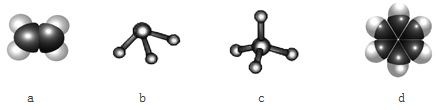
(4)比较元素②、③的最高价氧化物对应水化物的酸性:______>______(填化学式)。说明你判断的理由:_________。
(5)主族元素砷(As)的部分信息如图所示。
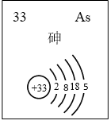
i.砷(As)在周期表中的位置是______。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. ③的气态氢化物的还原性大于砷的气态氢化物的还原性
(6)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。
已知:常温下浓盐酸与高锰酸钾反应生成氯气。
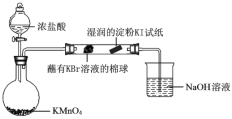
打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br > I,并说明理由_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯是重要有机化工原料。结合以下路线回答:
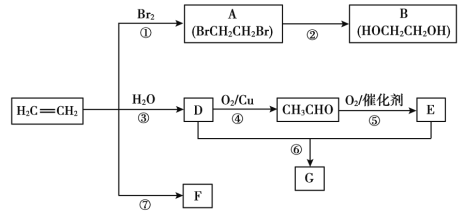
已知:2CH3CHO + O2催化剂,加热2CH3COOH
(1)反应①的化学方程式是_______。
(2)B的官能团是_______。
(3)F是一种高分子,可用于制作食品袋,其结构简式为_______。
(4)G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E反应制取G,装置如图所示。

i.反应⑥的化学方程式是______,反应类型是_____。
ii.分离出试管乙中油状液体用到的主要仪器是_______。
制法二:工业上用CH2=CH2和E直接反应获得G。
iii.反应类型是___。
iv.与制法一相比,制法二的优点是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃料电池是一种具有应用前景的绿色电源。下图为燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。请回答下列问题:
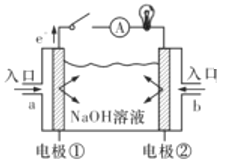
(1)若该燃料电池为氢氧燃料电池。
①a极通入的物质为_____(填物质名称),电解质溶液中的OH—移向______极(填”负”或“正”)。
②写出此氢氧燃料电池工作时,负极的电极反应式:______________。
(2)若该燃料电池为甲烷燃料电池。已知电池的总反应为CH4+2O2+2OH-=CO32-+3H2O
①下列有关说法正确的是___________(填字母代号)。
A.燃料电池将电能转变为化学能
B.负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O
C.正极的电极反应式为O2+4H++4e-=2H2O
D.通入甲烷的电极发生还原反应
②当消耗甲烷33.6L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为______mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】氯酸钾和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。
(1) 请补充空白并配平化学方程式。
____KClO3+____HCl(浓) → ____KCl+____ClO2↑+____Cl2↑+ ___
(2) 浓盐酸在反应中显示出来的性质是________(填序号)
A. 只有还原性 B. 还原性和酸性 C.只有氧化性 D.氧化性和酸性
(3) 若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为________。
(4) ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的______倍。
(5)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式:___________________________________。
取2.76 g CaO2·8H2O样品受热脱水过程的热重曲线(140 ℃时完全脱水,杂质受热不分解)如图所示。
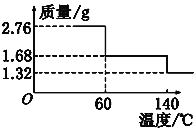
①试确定60 ℃时CaO2·xH2O中x=________。
②该样品中CaO2的质量分数为________。(保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com