
科目: 来源: 题型:
【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
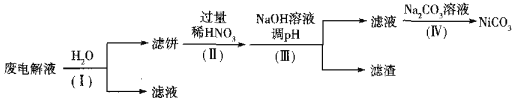
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.CO 还原NO 的脱硝反应:2CO(g)+2NO(g) 2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226 kJ·mol-1
N2(g)+2O2(g) 2NO2(g) △H2=+68 kJ·mol-1
N2(g)+O2(g) 2NO(g) △H3=+183 kJ·mol-1
脱硝反应△H=__________,有利于提高NO 平衡转化率的条件是________________(写出两条)。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为_________________;在n(NO)/n(CO)=1的条件下,应控制最佳温度在____________左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染,写出C2H6与NO2发生反应的化学方程式:_________。
③NO2尾气常用NaOH溶液吸收,生成NaNO3和NaNO2。已知NO2-的水解常数K=2×10-11,常温下某NaNO2和HNO2混合溶液的pH为5,则混合溶液中c(NO2-)和c(HNO2)的比值为__________。
II.T ℃时,在刚性反应器中发生如下反应:CO(g)+NO2(g) CO2(g)+NO(g),化学反应速率v =k Pm(CO)Pn(NO2),k 为化学反应速率常数。研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:

(3)若反应初始时P(CO)=P(NO2)=a kPa,反应t min时达到平衡,测得体系中P(NO)=b kPa,则此时v =___________ kPa·s-1(用含有a和b的代数式表示,下同),该反应的化学平衡常数Kp=_____(Kp是以分压表示的平衡常数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳。核黄素分子的结构如图。有关核黄素的下列说法中,不正确的是( )
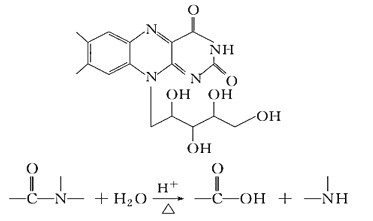
A. 该有机物的分子式为C17H21N4O6
B. 酸性条件下加热水解,有CO2生成
C. 酸性条件下加热水解,所得溶液加碱后有NH3生成
D. 该化合物能发生酯化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]()
![]() +OH
+OH
C. 由Na和C1形成离子键的过程:![]()
D. 电解精炼铜的阴极反应:Cu2+ +2e![]() Cu
Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,H2C2O4的电离常数:Ka1=5.4×10-2,Ka2=5.0×10-5。在V1mL0.1molL-1H2C2O4溶液中滴加0.1molL-1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示。下列说法正确的是( )
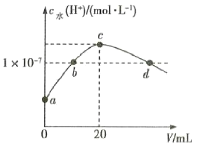
A.V1=20mL
B.b点和d点对应的溶液中都存在:c(K+)=c(HC2O4-)+2c(C2O42-)
C.常温下,加水稀释b点对应的溶液,稀释后溶液pH减小
D.常温下,KHC2O4的Kh1=2×10-10
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 18g氨基(-ND2)中含有的电子数为10NA
B. 一定质量的乙烷与22.4L(标准状况)Cl2在光照条件下发生取代反应,形成C-Cl键的数目为2NA
C. 用惰性电极电解100mL0.1mol·L-1的CuSO4溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数为0.04NA
D. n(H2SO3)和n(HSO3-)之和为1mol的KHSO3溶液中,含有的K+数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式包裹在冰晶之间,形成“盐泡”,其大致结构如图所示。若海冰的冰龄达到1年以上,则融化后的水为淡水。用NA表示阿伏加德罗常数的值,设冰的密度为0.9g/cm3。下列叙述正确的是

A.海冰内层“盐泡”越少,密度越大
B.海冰冰龄越短,内层的“盐泡”越少
C.冰的密度比水小是因为在固态冰中水分子间以氢键结合,排列更规整
D.每含1mol H2O的海冰内就有2×105 NA个NaCl分子
查看答案和解析>>
科目: 来源: 题型:
【题目】硒(Se)是人体必需的微量元素,在元素周期表中的位置如图所示。下列关于硒元素的叙述正确的是

A.硒元素位于元素周期表第四周期第IVA族
B.H2Se比HBr稳定
C.硒的非金属性比S弱
D.硒最高价氧化物对应水化物的化学式为H2SeO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com