
科目: 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上采用氨催化氧化法制备,生产过程中发生的反应有:
NH3(g)+![]() O2(g)
O2(g)![]() NO(g)+
NO(g)+![]() H2O(l) △H1= -292.3kJ/mol
H2O(l) △H1= -292.3kJ/mol
NO(g)+![]() O2(g)= NO2(g) △H2= -57.1kJ/mol
O2(g)= NO2(g) △H2= -57.1kJ/mol
3NO2(g)+ H2O(l)=2HNO3(aq)+NO(g) △H3= -71.7kJ/mol
回答以下问题:
(1) NH3(g)+2O2(g)=HNO3(aq)+ H2O(l) 的 △H= ___________ kJ/mol。原料气体(NH3、O2)在进入反应装置之前,必须进行脱硫处理。其原因是____。
(2)研究表明2NO(g)+ O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
(a)2NO(g)![]() N2O2(g)(快) (b)N2O2(g)+ O2(g)
N2O2(g)(快) (b)N2O2(g)+ O2(g)![]() 2NO2(g)(慢)
2NO2(g)(慢)
①该反应的速率由b步决定,说明b步反应的活化能比a步的 ___(填“大”或“小”)。
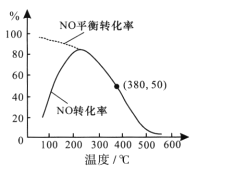
②在恒容条件下,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如图,则150℃时,v正___ v逆(填“>”或“<”)。若起始c(O2)=5.0×10-4mol/L,则380℃下反应达平衡时c(O2)=____mol/L。
(3) T1温度时,在容积为2L的恒容密闭容器中发生反应2NO+ O2![]() 2NO2,实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如下图所示:
2NO2,实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如下图所示:
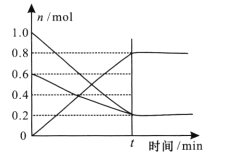
①下列说法能表明该反应已经达到平衡状态的是 ____填序号)
A. 混合气体的密度不变 B. 混合气体的颜色不变
C. k正、k逆不变 D. 2v正(O2)=v逆(NO2)
②化学平衡常数K与速率常数k正、k逆的数学关系式K=____。
③温度为T1时的化学平衡常数K= _____。若将容器的温度变为T2时,k正=k逆,则T2 ___T1(填“>
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组在实验室从海带中提取碘,设计实验流程如下:
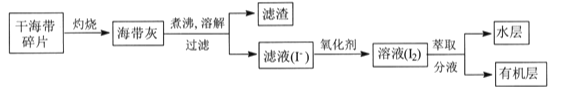
下列说法错误的是
A.过滤操作主要除去海带灰中难溶于水的固体,它们主要是无机物
B.氧化剂参加反应的离子方程式为2I-+H2O2+2H+=I2+2H2O
C.萃取过程所用有机溶剂可以是酒精或四氯化碳
D.因I2易升华,I2的有机溶液难以通过蒸馏法彻底分离
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.19g羟基(-18OH)所含中子数为10NA
B.标准状况下,44.8 L HF含有2NA个极性键
C.1 mol NaHSO4晶体含有的离子数为3NA
D.0.1 mol·L-1 KAl(SO4)2溶液中SO42-的数目为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A.CO全部转化为乙醇B.正反应和逆反应的化学反应速率均为0
C.CO和H2以1∶2的物质的量之比反应生成乙醇D.反应体系中乙醇的物质的量浓度不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】NO和CO都是汽车尾气里的有害物质,它们能缓缓地反应生成N2和CO2,化学方程式为2NO+2CO![]() N2+2CO2,对此反应,下列叙述错误的是( )
N2+2CO2,对此反应,下列叙述错误的是( )
A.使用正催化剂能加大反应速率
B.改变反应物的压强对反应速率产生影响
C.冬天气温低,反应速率降低,对人体危害更大
D.无论外界条件怎样改变,均对此化学反应的速率无影响
查看答案和解析>>
科目: 来源: 题型:
【题目】甲酸香叶酯是一种食品香料,可以由香叶醇与甲酸发生酯化反应制得。下列说法正确的是( )
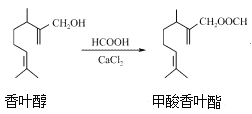
A. 香叶醇的分子式为C11H18O
B. 香叶醇在浓硫酸、加热条件下可发生消去反应
C. 香叶醇与CH2=CHCH=CHCH2OH互为同系物
D. 香叶醇与甲酸香叶酯均不能发生银镜反应
查看答案和解析>>
科目: 来源: 题型:
【题目】采用下列装置和操作,能达到实验目的的是( )
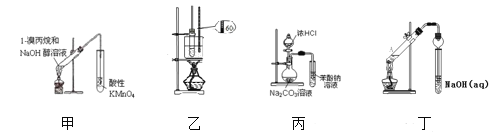
A. 装置甲可用于检验1—溴丙烷的消去产物B. 装置乙用于实验室制硝基苯
C. 装置丙可证明酸性:盐酸>碳酸>苯酚D. 装置丁用于制取乙酸乙酯
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜主要含有LiCoO2、A1等,处理该废料的一种工艺如下图所示:

回答下列问题:
(l) Li的原子结构示意图为____,LiCoO2中Co的化合价是____。
(2)“碱浸”时Al溶解的离子方程式为________。
(3)“酸溶”时加入H2O2的目的是____,调节pH后所得滤渣主要为____。
(4)“沉钴”的离子方程式为________。
(5)配制100mL l.0mol/L (NH4)2C2O4溶液,需要的玻璃仪器除玻璃棒、烧杯外,还需要____。
(6)取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g,则该反应的化学方程式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E为短周期元素,A、B、C在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。D与A同周期,其最高正价与最低负价代数和为零。A、E可形成AE3型分子,分子中只存在极性键。
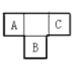
(1)B元素在元素周期表中的位置是____________________。
(2)C的离子结构示意图为__________________,用电子式表示AE3的形成过程:_______________________________________。
(3)由元素A、C及氢元素形成的化合物中含有的化学键的类型有____________。
(4)请设计一个实验来说明D与A的非金属性强弱(写出化学方程式即可)_________________在铜锌硫酸原电池中,若负极减少是13g,则正极产生__________升气体(标准状况)?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com