
科目: 来源: 题型:
【题目】工业上用焦炭与石英在高温下氮气流中发生如下反应,3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g) +Q(Q>0),可制得一种新型陶瓷材料氮化硅(Si3N4),该材料熔点高,硬度大 ,广泛应用于光伏、轴承、冶金、化工、能源、环保等行业。回答下列问题:
Si3N4(s)+6CO(g) +Q(Q>0),可制得一种新型陶瓷材料氮化硅(Si3N4),该材料熔点高,硬度大 ,广泛应用于光伏、轴承、冶金、化工、能源、环保等行业。回答下列问题:
(1)N2的电子式为____________,Si在元素周期表中的位置是_______________,氮化硅晶体属于__________晶体。
(2)该反应中,还原产物是______________。若测得反应生成22.4 L CO气体(标准状况下),则转移的电子的物质的量为_____________。
(3)该反应的平衡常数表达式K=__________________;若其他条件不变,降低温度,达到新的平衡时,K值____________(填“增大”、“减小”或“不变”,以下同)。CO的浓度_________,SiO2的质量______________。
(4)已知在一定条件下的2L密闭容器中制备氮化硅,SiO2(纯度98.5%,所含杂质不与参与反应)剩余质量和反应时间的关系如右图所示。CO在0~10min的平均反应速率为 _______ 。

(5)现用四氯化硅、氮气和氢气在高温下发生反应,可得较高纯度的氮化硅。反应的化学方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】卤块的主要成分是MgCl2,还含有少量Fe2+、Fe3+和Mn2+等杂质离子。现以卤块为原料按如下流程进行生产,以制备金属镁。

本流程操作条件下,生成氢氧化物沉淀的pH如下表:
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 7.6 | 8.3 | 10.0 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
*Fe2+氧氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+后生成Fe(OH)3沉淀除去。 请回答以下问题:
(1)步骤①中,为了加快酸溶速率,除了适当增加稀盐酸的浓度外,还可以采取的措施有 __________________________ (任写一条)。
(2)步骤②中NaClO的电子式为__________,加入NaClO溶液的目的是_________________________
(用离子方程式解释)。
(3)常温时,Mg(OH)2的Ksp=1.8×10-11。当溶液pH=10.0时,溶液中的c(Mg2+)=___________。
(4)若将步骤⑤中“稀盐酸”改为“加水、煮沸”的方式可以得到另一种沉淀物和一种无色无味的气体,请写出该反应的化学方程式__________________________________________。
(5)步骤⑥中涉及的操作是_____________________________,且⑥⑦操作均需在HCl气流中进行,其原因是_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在蒸馏实验中,下列叙述不正确的是( )
A.在蒸馏烧瓶中盛约![]() 体积的自来水,并放入几粒沸石
体积的自来水,并放入几粒沸石
B.将温度计水银球插入自来水中
C.冷水从冷凝管下口入,上口出
D.收集蒸馏水时,应弃去开始馏出的部分
查看答案和解析>>
科目: 来源: 题型:
【题目】将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
1 | 100 | 17.2 | 2.24 |
2 | 200 | 8.00 | 4.48 |
3 | 400 | 0 | V |
下列说法正确的是( )
A. 表中V=7.84 L
B. 原混合物粉末的质量为25.6 g
C. 原混合物粉未中铁和铜的物质的量之比为2:3
D. 实验3所得溶液中硝酸的物质的量浓度为0.875 molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写错误的是
A. 铝粉投入到NaOH溶液中:2Al+2H2O+2OH-=2AlO2-+3H2↑
B. Al(OH)3溶于NaOH溶液中:Al(OH)3 +OH-=AlO2- +2H2O
C. 碳酸氢钠水解: HCO3-+H2O![]() OH-+CO2↑+H2O
OH-+CO2↑+H2O
D. FeCl2溶液中通入Cl2:2Fe2++Cl2 =2Fe3++2Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】已知1mol氢气和氧气完全燃烧生成水蒸气放出241.8千焦热量,下列热化学方程式正确的是
A. 2H2(g)+O2(g)→2H2O(g)+241.8kJ
B. H2(g)+1/2O2(g)→H2O(s)+241.8 kJ
C. H2(g)+1/2O2(g)→H2O(g)-241.8 kJ
D. H2O(g)→H2(g)+1/2O2(g)-241.8 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图转化关系判断下列说法不正确的是(反应条件已略去)
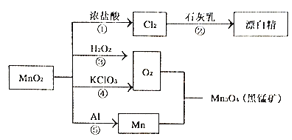
A. 反应①②③④⑤均属于氧化还原反应
B. 生成黑锰矿的反应中,3molMn参加反应转移4mol电子
C. 生成等量的O2,反应③和④转移的电子数之比为1:2
D. 反应⑤为铝热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种元素,A元素是地壳中含量最多的金属元素;B元素的原子其M层电子数比L层少1个电子;C元素的原子得到2个电子,D元素的原子失去1个电子,所得到的微粒都具有与氩原子相同的电子数,回答下列问题:
(1)上述四种元素的名称分别是A___________,B___________,C____________,D____________,
(2)画出A离子、C原子的结构示意图_____________________,__________________。
(3)写出D与水反应离子方程式______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化工生产原理正确的是
A. 工业制取烧碱:Na2O+H2O=2NaOH
B. 工业合成盐酸:H2+Cl2![]() 2HCl
2HCl
C. 工业制取乙烯:C2H5OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
D. 工业制漂粉精:2Ca(OH)2+2Cl2 =Ca(ClO)2+CaCl2+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】难溶性杂卤石(K2SO4MgSO42CaSO42H2O)在水中存在如下平衡K2SO4MgSO42CaSO42H2O (s)![]() 2Ca2++2K++ Mg2++4SO42-+2H2O,为能充分利用钾资源,用足量的饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾。工艺流程是:首先需要溶浸与分离,见下图:
2Ca2++2K++ Mg2++4SO42-+2H2O,为能充分利用钾资源,用足量的饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾。工艺流程是:首先需要溶浸与分离,见下图:

(1)不同温度下,K+的浸出浓度与溶浸时间的关系如下图,由图可得,随着温度升高①________________;②______________。

(2)为了提高浸出效率,可采取的措施是:________;过滤用到的玻璃仪器名称是:______。
(3)滤渣主要成分有_________和_________以及未溶杂卤石,用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石、浸出K+的原因: _________________________________。
(4) 溶浸与分离过滤后,滤液中的主要杂质离子是______,进一步“除杂”环节见下图。可先加入______溶液,经搅拌等操作后,过滤,再加入_________溶液调滤液pH至中性。

(5)中过滤得到的母液中含有大量的_____(填写化学式),检验其中溶质阴离子的方法是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com