
科目: 来源: 题型:
【题目】已知铅蓄电池充放电的总反应为:![]() ,下列关于铅蓄电池的说法正确的是( )
,下列关于铅蓄电池的说法正确的是( )
A. 在放电时,两极质量均增加
B. 在充电时,电池中硫酸的浓度不断变小
C. 在放电时,负极发生的反应是 Pb + 2e- + SO42-=PbSO4
D. 在放电时,正极发生的反应是 PbSO4 + 2e- =Pb + SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[(滴定时,1 mol (CH2)6N4H+与1 mol H+相当)],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500 g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇
匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积______(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察__________________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时的现象为_______________________________________________。
⑤滴定结束时俯视滴定管读数,则测得样品中氮的质量分数_____(填“偏高”、“偏低”或“无影响”)。
⑵滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
1 | 25.OO | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.2 | 25.02 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数是多少?_____(写出解题过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质为黄绿色有毒气体。请回答下列问题:
(1)Q的离子结构示意图是__________________。
(2)六种元素中,原子半径最大的是___________。(写元素符号)
(3)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)____________。
(4)Y和Z的气态氢化物中,热稳定性强的是________(用物质化学式表示)。
(5)Y的气态氢化物与X和M形成的化合物反应,产物的化学式为________,其中存在的化学键类型为____________________。
(6)X与Z可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:_______________________________________________________________。
(7)单质M与水反应的离子方程式为____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089 nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高 正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低 负化合价 | -2 | -3 | -1 | -3 |
(1)⑧号元素在周期表中的位置是______________________________;表格中元素处于同一主族的是__________________________________。 (用元素符号表示)
(2)元素①和⑥能形成两种化合物,写出这两种化合物的电子式_______________________;________________________。
(3)④和⑤元素最高价氧化物对应的水化物酸性较强的是________(用物质化学式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在 400mL 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL (标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大______min(填“0~1”“1~2”“2~3”“3~4”或“4~5”),原因是______。
②求 3~4 min 时间段以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是______ (填字母)。
A.蒸馏水 B.KCl 溶液 C.KNO3 溶液 D.CuSO4 溶液
(3)某温度下在 4 L 密闭容器中,X、Y、Z 三种气态物质的物质的量随时间变化曲线如图:
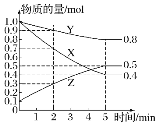
①该反应的化学方程式是______。
②该反应达到平衡状态的标志是_______(填字母)。
A.Y 的体积分数在混合气体中保持不变
B.X、Y 的反应速率比为 3:1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成 1mol Y 的同时消耗 2mol Z
③2 min 内 Y 的转化率为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):
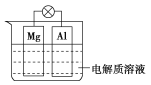
(1)电解质溶液为稀硫酸时,灯泡亮,Mg电极上发生的反应为____________________;Al电极上发生的反应为_____________________________。溶液中![]() 向_____移动(填“Mg电极”或“Al电极”)。当电路中转移0.5 mol电子时,理论上消耗负极材料的质量为___ g。
向_____移动(填“Mg电极”或“Al电极”)。当电路中转移0.5 mol电子时,理论上消耗负极材料的质量为___ g。
(2)电解质溶液为NaOH溶液时,灯泡________(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,Al电极上发生的反应为____________________________。
b.若灯泡不亮,其理由为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) ![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等 D. 单位时间内生成1 mol Y的同时生成2 mol X
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积固定容器中,发生反应2HI(g)![]() H2(g)+I2(g), 下列方法中能证明已达到平衡状态的是( )
H2(g)+I2(g), 下列方法中能证明已达到平衡状态的是( )
①混合气体的颜色不再变化 ②![]() 各组分浓度相等 ③
各组分浓度相等 ③![]()
④一个H-H键断裂的同时有两个H-I键断裂 ⑤混合气体的平均摩尔质量不再变化
A. ①④ B. ①②④ C. ①③⑤ D. ①④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )
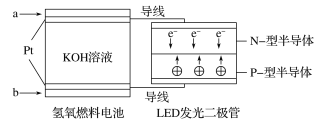
A.a处通入氧气,b处通入氢气
B.通入H2的电极发生反应:H2-2e-=2H+
C.通入O2的电极为电池的正极
D.该装置将化学能最终转化为电能
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H是合成抗心律失常药物泰达隆的一种中间体,可通过以下方法合成:
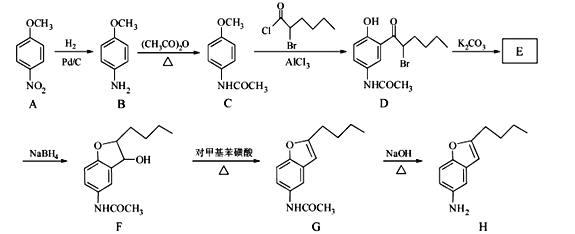
(1)D中的含氧官能团名称为_____________(写两种)。
(2)F→G的反应类型为_____________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式_________________。
①能发生银镜反应;②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(4)E经还原得到F,E的分子式为C14H17O3N,写出E的结构简式_____________。
(5)G→H的反应方程式为______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com