
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在 400mL 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL (标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大______min(填“0~1”“1~2”“2~3”“3~4”或“4~5”),原因是______。
②求 3~4 min 时间段以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是______ (填字母)。
A.蒸馏水 B.KCl 溶液 C.KNO3 溶液 D.CuSO4 溶液
(3)某温度下在 4 L 密闭容器中,X、Y、Z 三种气态物质的物质的量随时间变化曲线如图:
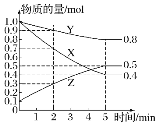
①该反应的化学方程式是______。
②该反应达到平衡状态的标志是_______(填字母)。
A.Y 的体积分数在混合气体中保持不变
B.X、Y 的反应速率比为 3:1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成 1mol Y 的同时消耗 2mol Z
③2 min 内 Y 的转化率为_______。
【答案】2~3 min 该反应是放热反应,此时温度高,反应速率越大 0.025 mol/(Lmin) CD 3X+Y![]() 2Z AC 10%
2Z AC 10%
【解析】
(1)①相同条件下,反应速率越大,相同时间内收集的气体越多;由表中数据可知,反应速率最大的时间段是2~3 min,原因是:该反应是放热反应,温度越高,反应速率越大;
②3~4分钟时间段,收集的氢气体积=(576-464)mL=112mL,n(H2)=0.112L÷22.4L/mol=0.005mol,根据氢气和HCl关系式得消耗的n(HCl)=2(H2)=2×0.005mol=0.01mol,则V(HCl)=0.01mol÷(0.4L×1min)=0.025 mol/(Lmin);
(2)A.加入蒸馏水,氢离子浓度减小,反应速率降低,故A不选;
B.加入KCl溶液,氢离子浓度降低,反应速率降低,故B不选;
C.加入KNO3溶液,相当于含有硝酸,硝酸和Zn反应生成NO而不是氢气,故C选;
D.加入CuSO4溶液,Zn和铜离子反应生成Cu,Zn、Cu和稀盐酸构成原电池而加快反应速率,故D选;
故选:CD;
(3)①根据图知,随着反应进行,X、Y的物质的量减少而Z的物质的量增加,则X和Y是反应物而Z是生成物,反应达到平衡时,△n(X)=(1.0-0.4)mol=0.6mol、△n(Y)=(1.0-0.8)mol=0.2mol、△n(Z)=(0.5-0.1)mol=0.4mol。同一可逆反应中,同一段时间内参加反应的各物质的物质的量变化量之比等于其计算之比,X、Y、Z的计量数之比=0.6mol:0.2mol:0.4mol=3:1:2,则该反应方程式为3X+Y![]() 2Z;
2Z;
②A.Y的体积分数在混合气体中保持不变,说明各物质的物质的量不变,反应达到平衡状态,故A正确;
B.X、Y的反应速率比为3:1时,如果反应速率都是指同一方向的反应速率,则该反应不一定达到平衡状态,故B错误;
C.反应前后气体压强减小,当容器内气体压强保持不变时,各物质的物质的量不变,反应达到平衡状态,故C正确;
D.容器内气体的总质量一直保持不变,故D错误;
E.只要反应发生就有生成1molY的同时消耗2molZ,故E错误;
故选:AC;
③Y的转化率=反应的n(Y)÷反应初始n(Y)×100%=(1-0.9)÷1×100%=10%。


科目:高中化学 来源: 题型:
【题目】凯夫拉纤维是生产防弹衣的主要材料之一,其结构片段如下:
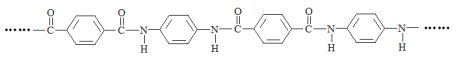
下列说法不正确的是( )
A. 凯夫拉纤维在发生水解反应的过程中,![]() 中的C—N键断裂
中的C—N键断裂
B. 凯夫拉纤维的结构简式为: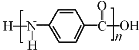
C. 完全水解产物的单个分子中,苯环上的氢原子具有相同的化学环境
D. 通过质谱法测定凯夫拉纤维的平均相对分子质量,可得其聚合度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2A(g) + 3B(g) ![]() 2C(g)+D(g),在四种不同条件下的反应速率分别为:
2C(g)+D(g),在四种不同条件下的反应速率分别为:
①υ(A)=0.5mol·L-1·min-1 ②υ(B)=0.6 mol·L-1·min-1
③υ=0.35 mol·L-1·min-1 ④υ(D)=0.4 mol·L-1·min-1
该反应在这四种不同条件下反应速率由快到慢的顺序是
A. ①②③④ B. ②①④③ C. ④①②③ D. ②④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图装置中的变化叙述错误的是
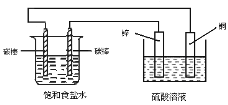
A.电子经导线从锌片流向右侧碳棒,再从左侧碳棒流回铜片
B.铜片上发生氧化反应
C.右侧碳棒上发生的反应:2H++2e→H2 ↑
D.铜电极出现气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲池的总反应式为2CH3OH+ 3O2+ 4KOH=2K2CO3+ 6H2O。试回答:
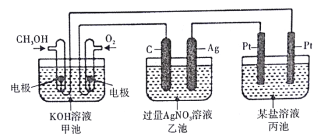
(1)图中甲池的装置是_________(填“原电池”或“电解池”),乙池中石墨电极是________极。
(2)写出通入CH3OH的电极的电极反应式:________________
(3)乙池中总反应的化学方程式为___________________
(4)当乙池中Ag极的质量增加5.40g时,甲池中理论上消耗O2________mL(标准状况);此时丙池某电极上析出1.60g某金属,则丙池中的盐溶液可能是________(填字母)
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H=-34kJ/mol
H2S(g)+CO2(g) △H=-34kJ/mol
氢解反应:COS(g)+H2(g) ![]() H2S(g)+CO(g) △H=+7kJ/mol。
H2S(g)+CO(g) △H=+7kJ/mol。
已知:2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol。
写出表示CO燃烧热的热化学方程式:______________。
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率____(填“增大”“减小”或“不变”,下同),COS的转化率_______。
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5min内,v(H2S)=_______mol·L-1·min-1。
②该温度下,上述水解反应的平衡常数K=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.SiO2既能和NaOH溶液反应,又能和HF反应,所以SiO2属于两性氧化物
B.因为Na2CO3+SiO2![]() Na2SiO3+CO2↑,所以H2SiO3的酸性比H2CO3强
Na2SiO3+CO2↑,所以H2SiO3的酸性比H2CO3强
C.CO2和SiO2都能与C反应
D.CO2和SiO2都是酸性氧化物,所以两者物理性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. Cl2通入水中:Cl2+H2O = 2H++Cl-+ClO-
B. 双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
C. 用铜做电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D. Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com