
【题目】凯夫拉纤维是生产防弹衣的主要材料之一,其结构片段如下:
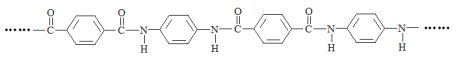
下列说法不正确的是( )
A. 凯夫拉纤维在发生水解反应的过程中,![]() 中的C—N键断裂
中的C—N键断裂
B. 凯夫拉纤维的结构简式为: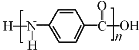
C. 完全水解产物的单个分子中,苯环上的氢原子具有相同的化学环境
D. 通过质谱法测定凯夫拉纤维的平均相对分子质量,可得其聚合度
科目:高中化学 来源: 题型:
【题目】下列实验可以实现的是

A. 装置①可检验溴乙烷发生消去反应得到的气体为乙烯
B. 装置②中的CuSO4溶液可用于除去杂质
C. 装置③a处有红色物质生成,b处变蓝,证明X一定是H2
D. 装置④可用于实验室制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,关于该物质的叙述错误的是( )
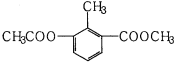
A.一个分子中含有12个H原子
B.苯环上的一氯代物有2种
C.能使酸性KMnO4溶液褪色
D.1mol该物质分别与足量H2、NaOH溶液反应,消耗其物质的量均为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁泥(主要成分为Fe2O3、FeO和少量Fe)制备超顺磁性(平均直径25nm)纳米Fe3O4的流程示意图如下:

下列叙述不正确的是
A.常用热的Na2CO3溶液除去钢铁表面的油污
B.步骤②中,主要反应的离子方程式是2Fe3++Fe=3Fe2+
C.步骤④中,反应完成后剩余的H2O2无需除去
D.步骤⑤中,为了验证得到的固体是超顺磁性的Fe3O4粒子,可将其均匀分散在水中,做丁达尔效应实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列两种物质的说法,正确的是


A. 核磁共振氢谱都有3个吸收峰
B. 都不能发生消去反应
C. 都能与Na反应生成H2
D. 都能在Cu作催化剂时发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
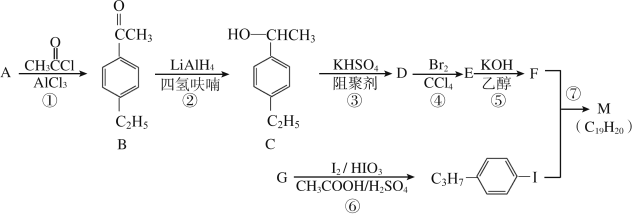
回答下列问题:
(1)A的结构简式为_______。
(2)D分子中最多有_____个碳原子共平面,与D化学式相同且符合下列条件的同分异构体有__种。(①与D具有相同的官能团,②苯环上的三元取代物)
(3)①的反应类型是________。
(4)⑤的化学方程式为________。
(5)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线:______________。
的合成路线:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA代表阿伏加德罗常数,下列说法正确的是( )
A. 46gNO2和N2O4的混合液中总原子数为3NA
B. 4℃时9mL水和11.2L氮气含有相同的分子数
C. 同温同压下,NA个CO2与NA个N2和O2的混合气体的体积不相等
D. 1.01×105Pa时,11.2 L氧气所含的原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在_____________________范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为_____________________________________________________________。
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为_________________________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为_________。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-=2Fe2++I2 2S2O32-+I2=2I-+S4O62-
则溶液中铁元素的总含量为_________g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会_______ (填“偏高” “偏低” “不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在 400mL 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL (标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大______min(填“0~1”“1~2”“2~3”“3~4”或“4~5”),原因是______。
②求 3~4 min 时间段以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是______ (填字母)。
A.蒸馏水 B.KCl 溶液 C.KNO3 溶液 D.CuSO4 溶液
(3)某温度下在 4 L 密闭容器中,X、Y、Z 三种气态物质的物质的量随时间变化曲线如图:
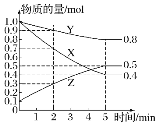
①该反应的化学方程式是______。
②该反应达到平衡状态的标志是_______(填字母)。
A.Y 的体积分数在混合气体中保持不变
B.X、Y 的反应速率比为 3:1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成 1mol Y 的同时消耗 2mol Z
③2 min 内 Y 的转化率为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com