
科目: 来源: 题型:
【题目】某温度下,在一个1L 的密闭容器中,X、Y、Z 三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:
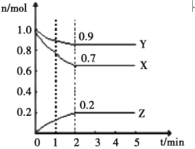
(1)2min时,Y 的物质的量浓度是____________;
(2)从开始至2min,X 的平均反应速率为_________;
(3)该反应的化学方程式为____________________;
(4)1min时,v(正)____v(逆),2min时,v(正)____v(逆) (填“>”或“<”或“=”);
(5)在2min时,向容器中通入氩气,增大体系压强,X 的化学反应速率将______;
(6)2min时,x的转化率为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高分子PMMA是迄今为止合成透明材料中质地最优异、价格又比较适宜的品种。其中一种合成路线如图:
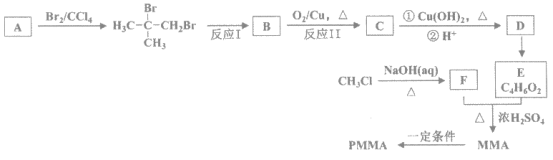
(1)A的分子式是__________。
(2)反应II的化学方程式是____________________。
(3)由MMA制取高分子PMMA的化学方程式是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】从铜转炉烟灰(主要成分ZnO还有Pb、Cu、Cd、As、Cl、F等元素)中回收锌、铜、铅等元素进行资源综合利用,具有重要意义。以铜转炉烟灰制备重要化工原料活性氧化锌的工艺流程如图所示。
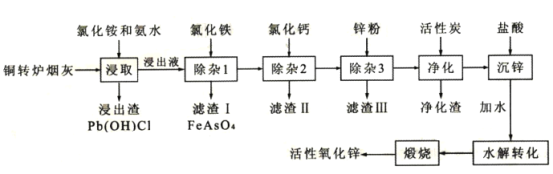
己知:活性炭净化主要是除去有机杂质。
请回答以下问题:
(1)若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___。
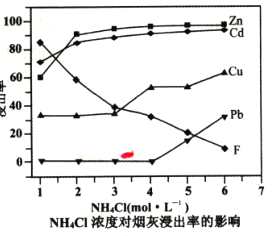
(2)在反应温度为50℃,反应时间为lh时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,结合流程图分析,氯化铵适宜的浓度为___ mo1·L-1。
(3)若浸出液中c(AsO43-)=6.0×10-3molL-1,现将8.0×10-3mo1L-1FeC13溶液与浸出液等体积混合生成砷酸铁沉淀。若该温度时Ksp(FeAsO4)=2.0×10-22,则反应后溶液中c(AsO43-)=___mo1L-1。
(4)滤渣II的主要成分为___;除杂3是置换除杂过程,则此过程主要除去的金属有___(填化学式)。
(5)沉锌得到的物质为Zn(NH3)2C12,请写出水解转化的化学方程式___。
(6)该流程中可以循环使用的物质的电子式为___。
(7)取mg活性氧化锌样品,预处理后配成待测液,加入指示剂3、4滴,再加入适量六亚甲基四胺,用amolL-1EDTA标准液进行滴定,消耗标准液VmL。己知:与1.0mLEDTA标准液[c(EDTA)=1.000mo1L-1]相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为___(用代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物P的合成路线如下:

已知: (R、R'、R'代表烃基或氢)
(R、R'、R'代表烃基或氢)
(1)A的分子式为C3H8O,其所含的官能团名称是__________。
(2)B的核磁共振氢谱只有一个吸收峰,其结构简式是__________。
(3)由D生成有机物P的反应类型是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】依据图中氮元素及其化合物的转化关系,回答问题:
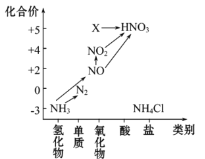
(1)上图中 X 的化学式为______,从化合价上看,X 具有_______性(填“氧化”或“还原”);
(2)写出 NO2 与水反应的化学方程式____________;
(3)写出稀硝酸与铜反应的离子方程式____________;
(4)实验室常用 NH4Cl与 Ca(OH)2 制取氨气,写出反应的化学方程式_________;
(5)下列试剂不能用于干燥 NH3 的是________ (填字母);
A.浓硫酸 B.碱石灰 C.NaOH 固体
(6)氨气是重要的化工原料,写出其催化氧化的化学方程式__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种具有强氧化性的黄绿色气体,也是优良的消毒剂,熔点-59℃、沸点11℃,易溶于水,易与碱液反应。ClO2浓度大时易分解爆炸,在生产和使用时必须用稀有气体或空气等进行稀释,实验室常用下列方法制备:2NaC1O3+Na2SO3+H2SO4![]() 2C1O2↑+2Na2SO4+H2O。
2C1O2↑+2Na2SO4+H2O。
(1)H2C2O4可代替Na2SO3制备ClO2,该反应的化学方程式为___,该方法中最突出的优点是___。
(2)ClO2浓度过高时易发生分解,故常将其制备成NaClO2固体,以便运输和贮存。
已知:2NaOH+H2O2+2ClO2=2NaClO2+O2+2H2O,实验室模拟制备NaC1O2的装置如图所示(加热和夹持装置略)。
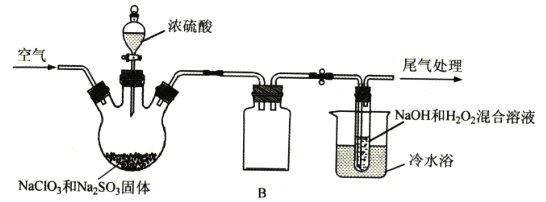
①产生ClO2的温度需要控制在50℃,应采取的加热方式是___;盛放浓硫酸的仪器为:___;NaC1O2的名称是___;
②仪器B的作用是___;冷水浴冷却的目的有___(任写两条);
③空气流速过快或过慢,均会降低NaC1O2的产率,试解释其原因___。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,下面表示的反应速率最快的是
A.v(A)=0.5mo1/(L·s)B.v(B)=1.8mo1/(L·min)
C.v(C)=0.9mo1/(L·s)D.v(D)=1.0mo1/(L·s)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列四种重要的有机物。
CH2=CH2 

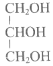
① ② ③ ④
(1)常用作液体燃料的是________(填序号,下同)。
(2)常用作配制化妆品保湿成分的是________。
(3)能用于制备酚醛树脂的是________。
(4)其产量常作为衡量石油化工发展水平的标志的是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验测得0.1mo1·L-1Na2SO3溶液pH随温度升高而变化的曲线如图所示。将b点溶液冷却至25℃,加入盐酸酸化的BaC12溶液,能明显观察到白色沉淀。下列说法正确的是( )

A.Na2SO3溶液中存在水解平衡SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
B.温度升高,溶液pH降低的主要原因是SO32-水解程度减小
C.a、b两点均有c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D.将b点溶液直接冷却至25℃后,其pH小于a点溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】某锂离子电池充电时的工作原理如图所示,LiCoO2中的Li+穿过聚内烯微孔薄膜向左迁移并嵌入石墨(C6表示)中。下列说法错误的是( )
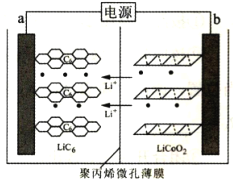
A.充电时,阳极电极反应式为LiCoO2-xe-=xLi++Lil-xCoO2
B.放电时,该电池将化学能转化为电能
C.放电时,b端为负极,发生氧化反应
D.电池总反应为LixC6+Lil-xCoO2![]() C6+LiCoO2
C6+LiCoO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com