
科目: 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
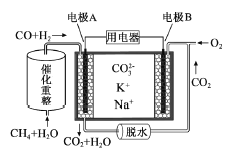
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)请写出A装置中发生反应的化学方程式_____。
(2)饱和食盐水的作用是_____。
(3)装置B中盛放的试剂是_____(选填下列所给试剂的代码),反应离子方程式是_____。
A.N![]() S溶液 B.N
S溶液 B.N![]() S
S![]() 溶液 C.N
溶液 C.N![]() S
S![]() 溶液
溶液
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强_____(填编号)
①HCl比![]() S稳定 ②HClO氧化性比
S稳定 ②HClO氧化性比![]() S
S![]() 强 ③HCl
强 ③HCl![]() 酸性比
酸性比![]() S
S![]() 强 ④HCl酸性比
强 ④HCl酸性比![]() S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与C
S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与C![]() 反应生成FeC
反应生成FeC![]() ,而硫与铁反应生成FeS
,而硫与铁反应生成FeS
(5)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CC![]() ,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
查看答案和解析>>
科目: 来源: 题型:
【题目】能源、材料和信息是现代社会的三大“支柱”。
(1)目前,利用金属或合金储氢的研究已取得很大进展,图是一种镍基合金储氢后的晶胞结构图.
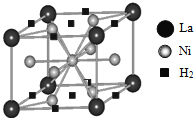
①Ni原子的价电子排布式是_____。
②该合金储氢后,含1mol La的合金可吸附![]() 的数目为_____。
的数目为_____。
(2)南师大结构化学实验室合成了一种多功能材料--对硝基苯酚水合物(化学式为![]() N
N![]() 1.5
1.5![]() O)。实验表明,加热至94℃时该晶体能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
O)。实验表明,加热至94℃时该晶体能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
①晶体中四种基本元素的电负性由大到小的顺序是_____。
②对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是_____。
(3)科学家把NaN![]() 和N
和N![]() O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构.该阴离子的电子式是_____,其中心原子N的杂化方式是_____。
O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构.该阴离子的电子式是_____,其中心原子N的杂化方式是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ 某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质.
(1)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备。
①甲同学的操作是:取一小烧杯,加入25mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。
②乙向饱和FeCl3溶液直接加入过量的NaOH溶液。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟。
你认为哪位同学的制备方法正确:_______,发生的化学方程式是______________。
(2)Fe(OH)3胶体稳定存在的主要原因是_____。
A.胶粒小,不受重力作用 B.胶粒带同种电荷
C.胶体具有丁达尔效应 D.胶粒能透过滤纸
(3)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________________________。
A.Fe(OH)3胶体粒子的直径在1~100nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
Ⅱ 根据如图所示实验装置,回答下列问题:

(1)写出下列仪器的名称:②_________,⑦__________。
(2)上述仪器中实验之前需检查装置是否会漏水的有_________________(填仪器名称)。
(3)利用装置甲制备蒸馏水时,冷凝水应从___________(填“f”或“g”)口进入。
(4)利用装置乙用CCl4从碘水中萃取碘,振荡静置后看到的现象是:________________。
(5)利用装置丁进行实验时,玻璃棒的作用是:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(![]() )广泛存在于食品中,人们对其及相关产品进行了深入研究。
)广泛存在于食品中,人们对其及相关产品进行了深入研究。
(1) ![]() (s)═
(s)═ ![]() O(g)+CO(g)+C
O(g)+CO(g)+C![]() (g)△H=+340kJmo
(g)△H=+340kJmo![]() 在密闭容器中反应,保持温度不变,下列有关选项正确的是_____(填序号)
在密闭容器中反应,保持温度不变,下列有关选项正确的是_____(填序号)
A 恒容时,容器的压强不再变化,说明该反应已达到化学平衡状态
B 恒压时,容器的体积不再变化,说明该反应已达到化学平衡状态
C 气体摩尔体积不再发生变化,说明该反应已达到化学平衡状态
D 气体平均摩尔质量不再发生变化,说明该反应已达到化学平衡状态
E 气体总质量不再发生变化,说明该反应已达到化学平衡状态
(2)草酸分解所需燃料可以是CO,通过甲烷制备CO:C![]() (g)+C
(g)+C![]() (g)→2CO(g)+2
(g)→2CO(g)+2![]() (g)△H>O.常温下,在2L的密闭容器中通入4molC
(g)△H>O.常温下,在2L的密闭容器中通入4molC![]() 气体和6molC
气体和6molC![]() 气体发生反应,5min后达到平衡,测得CO气体的浓度为0.1mol
气体发生反应,5min后达到平衡,测得CO气体的浓度为0.1mol![]() 。
。
①平衡时,该反应的平均反应速率v(C![]() )=_____mol
)=_____mol![]() mi
mi![]() 。
。
②在不改变反应混合物用量的前提下,为了提高C![]() 气体的转化率,可采取的措施是_____。(答出一方面即可)
气体的转化率,可采取的措施是_____。(答出一方面即可)
(3)草酸(![]() )是二元弱酸,KH
)是二元弱酸,KH![]() 溶液呈酸性。向10mL 0.01mol
溶液呈酸性。向10mL 0.01mol![]() 的
的![]() 溶液滴加0.01mol
溶液滴加0.01mol![]() KOH溶液V(mL),回答下列问题。
KOH溶液V(mL),回答下列问题。
①当V=10mL时,溶液中H![]() 、
、![]() 、
、![]() 、
、![]() 的浓度从大到小的顺序为_____。
的浓度从大到小的顺序为_____。
② 当V=a mL时,溶液中离子浓度有如下关系:c(![]() )=2c(
)=2c(![]() )+c(H
)+c(H![]() );当V=b mL时,溶液中离子浓度有如下关系:c(
);当V=b mL时,溶液中离子浓度有如下关系:c(![]() )=c(
)=c(![]() )+c(H
)+c(H![]() )+c(
)+c(![]() );则a_____b(填“<”,“=”或“>”)。
);则a_____b(填“<”,“=”或“>”)。
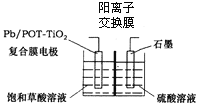
(4)电解饱和草酸溶液可以制得高档香料乙醛酸(![]() ),装置如图所示,写出复合膜电极的电极反应式_____。
),装置如图所示,写出复合膜电极的电极反应式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】相对分子质量为M的气态化合物VL(标准状况)溶于mg水中,得到溶液的质量分数为ω%,物质的量浓度cmol/L,密度为ρg/cm3,则下列说法正确的是
A. 相对分子质量M可表示为:![]()
B. 溶液密度ρ可表示为:![]()
C. 溶液的质量分数ω%可表示为:![]()
D. 物质的量浓度C可表示为:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】化工原料异丁烯(C4H8)可由异丁烷(C4H10)直接催化脱氢制备:C4H10(g) ![]() C4H8(g) + H2(g)ΔH=+139 kJ/mol
C4H8(g) + H2(g)ΔH=+139 kJ/mol
(1)该反应的化学平衡常数的表达式为_________________。
(2)一定条件下,以异丁烷为原料生产异丁烯。温度、压强改变对异丁烷平衡转化率的
影响如下图所示。
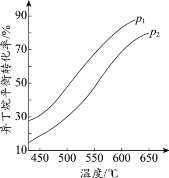
①判断p1、p2的大小关系:p1_________________(填“>”或“<”)p2,理由是_________________。
②若异丁烷的平衡转化率为40%,则平衡混合气中异丁烯的物质的量分数最多为______%(保留小数点后1位)。
(3)目前,异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-O为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。
温度/℃ | 570 | 580 | 590 | 600 | 610 | |
以γ-Al2O3为载体 | 异丁烷转化率/% | 36.41 | 36.49 | 38.42 | 39.23 | 42.48 |
异丁烯收率/% | 26.17 | 27.11 | 27.51 | 26.56 | 26.22 | |
以TiO2为载体 | 异丁烷转化率/% | 30.23 | 30.87 | 32.23 | 33.63 | 33.92 |
异丁烯收率/% | 25.88 | 27.39 | 28.23 | 28.81 | 29.30 | |
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是____________(填字母序号)。
a.载体会影响催化剂的活性
b. 载体会影响催化剂的选择性
c.载体会影响化学平衡常数
②分析以γ-Al2O3为载体时异丁烯收率随温度变化的可能原因:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com