
科目: 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目: 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为____________,3d能级上的未成对电子数为________。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是__________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是________。
③氨的沸点________(填“高于”或“低于”)膦(PH3),原因是___________;氨是________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为________。
(3)单质铜及镍都是由________键形成的晶体。
查看答案和解析>>
科目: 来源: 题型:
【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分是Li2O·Al2O3·4SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如下:
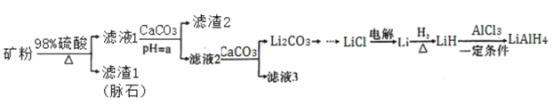
已知:①几种金属氢氧化物沉淀的pH如表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3,Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有________________、加热;加入CaCO3的作用是_____,“a”的最小值为______________。
(2)写出LiH和AlC13反应的化学方程式为_____________(条件不作要求)。
(3)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是_______________。
(4)四氢铝锂LiAlH4溶解于NaOH溶液后得到无色透明溶液,并产生一种无色气体。请写出该反应的离子方程式_____________________。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力。LiAlH4的“有效氢”为________________(结果保留2位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,NaCN溶液中CN-、HCN浓度所占分数(![]() )随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的
)随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的
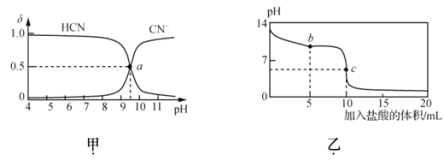
A.图甲中pH=7的溶液:c(Cl-)=c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol/L
C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+ c(H+)= c(HCN)+ c(OH-)+ c(CN-)
查看答案和解析>>
科目: 来源: 题型:
【题目】在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加人Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、金在元素周期表中位于同一族相邻周期,基态银原子的最外层电子排布式为 _______。
(2)Na、O、S简单离子半径由大到小的顺序为______________________。
(3)S2O32-离子结构如图所示,其中心硫原子的杂化轨道类型为_______________________。

(4)写出AgBr 溶于Na2S2O3溶液的离子反应方程式______________。Na3[Ag(S2O3)2]中存在的作用力有离子键、共价键、______________。
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2 分子中硫原子的价层电子对数为_________,其分子空间构型为______________。 SO2易溶于水,原因是________________________________。
(6)现在人们已经有多种方法来测定阿伏加德罗常数,X射线衍射法就是其中的一种,通过对金晶体的X 射线衍射图象的分析,可以得出金晶体的晶胞属于面心立方晶胞(与铜的晶胞相似)。若金原子的半径为am,金的密度为ρg·cm-3,金的摩尔质量为Mg·mol -1,试通过这些数据列出计算阿伏加德罗常数的算式______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:有下列物质:①O2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩N2,回答下列问题:
(1)只含有极性键的是________;只含有非极性键的是________;含有极性键和非极性键的是________;只含有离子键的离子化合物是________;含有非极性键的离子化合物是________;
(2)写出⑤、⑧、⑨的电子式_____________、______________、________________;
(3)溶于水只破坏离子键的是__________;溶于水既破坏离子键又破坏共价键的是________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】下列四个数据都表示合成氨的反应速率,其中速率相等的是( )
①![]() (N2)=0.6mol/(L·min) ②
(N2)=0.6mol/(L·min) ②![]() (NH3)=1.8mol/(L·min)
(NH3)=1.8mol/(L·min)
③![]() (H2)=1.2mol/(L·min) ④
(H2)=1.2mol/(L·min) ④![]() (H2)=0.045mol/(L·s)
(H2)=0.045mol/(L·s)
A. ①②B. ①③C. ③④D. ②④
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧燃料电池已用于航天飞机,其工作原理如图所示。关于该燃料电池的说法不正确的是
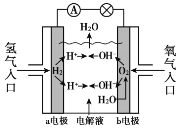
A. H2在负极发生氧化反应
B. 电子从a电极经外电路流向b电极
C. 供电时的总反应为:2H2 + O2 == 2H2O
D. 燃料电池的能量转化率可达100%
查看答案和解析>>
科目: 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )

A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目: 来源: 题型:
【题目】对下列化学用语的理解和描述均正确的是
A. 电子式![]() 可以表示羟基.也可以表示氢氧根离子
可以表示羟基.也可以表示氢氧根离子
B. 填充模型![]() 可以表示二氧化碳分子,也可以表示水分子
可以表示二氧化碳分子,也可以表示水分子
C. 原子结构示意图![]() 可以表示12C,也可以表示14C
可以表示12C,也可以表示14C
D. 结构示意图为![]() 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com