
科目: 来源: 题型:
【题目】X、Y、Z、W均为短周期主族元素,X、Y、Z原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。W的最外层电子数等于X的核外电子总数,且W单质常温下为固体。请回答下列问题:
(1)Z在周期表中的位置为______________。
(2)Y元素形成的离子的结构示意图为____________。
(3)X、Y、Z三种元素对应的原子半径大小关系为____________(填元素符号)。
(4)X和Z形成的简单氢化物,热稳定性较好的是______________(填化学式)。
(5)Y与X的最高价氧化物在一定条件下反应的实验现象是___________________________。
(6)下列说法正确的是_______。
A.W的氧化物,均满足8e—稳定结构
B.最高价氧化物对应的水化物的酸性W>Z
C.由于Z的氧化物ZO2既可与酸反应,又能与碱反应,所以ZO2为两性氧化物
D.W的氧化物WO2,具有还原性,能使酸性KMnO4溶液褪色
(7)足量的单质Y与一定量的W的最高价氧化物对应的水化物的浓溶液,在一定条件下充分反应,所得气体的成分为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2是一种重要的氧化物,可用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也可用作熏蒸剂、防腐剂、消毒剂、还原剂等。
(1)SO2性质多变,若将SO2气体通入氢硫酸中,能看到的现象为:__________,该反应中SO2表现出______性;若将SO2气体通入酸性高锰酸钾溶液中,离子反应方程式为_________,该反应中SO2表现出__________性。
(2)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2CaSO4·2H2O碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式__________;
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
余石灰-石膏法相比,碱法的优点是吸收快、效率高,缺点是__________;
(3)在石灰-石膏法和碱法的基础上,设计了双碱法,能实现物料循环利用。

上述方法中,实现循环利用的物质是__________,请用化学方程式表示在Na2SO3溶液中加入CaO后的反应原理__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种防止血栓形成与发展的药物J的合成路线如图所示(部分反应条件略去):
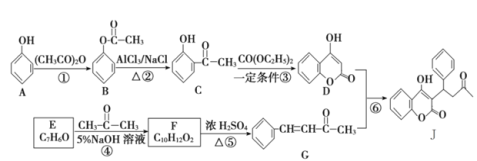
回答下列问题:
(1)A中官能团的名称是_________,反应⑤的反应类型是___________。
(2)J的分子式是__________。F的结构简式是_________。
(3)反应③的化学方程式为____________________________________。
(4)已知C有多种同分异构体。写出同时满足下列条件的C的同分异构体的结构简式__________。(只需写出两个)
①苯环上有两个处于对位上的取代基;
②1mol该有机物与足量金属钠反应生成1g氢气。
(5)请参照J的合成方法,完成下列合成路线:___________________

查看答案和解析>>
科目: 来源: 题型:
【题目】航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷燃料电池以KOH溶液为电解质,其总反应的化学方程式为:CH4+2O2+2OH-===CO32—+3H2O。
(1)负极上的电极反应为____________________________________。
(2)消耗标准状况下的5.6 L O2时,有________ mol电子发生转移。
(3)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)药物安全是国家高度重视的民生问题,化学在新型药物的研究中贡献巨大。根据题意,用下列选项的字母代号填空。
A.阿司匹林(乙酸水杨酸) B.青霉素 C.抗酸药(氢氧化铝) D.麻黄碱
①治疗胃酸过多,但患有严重的胃溃疡,应该选择_______;
②可治疗支气管哮喘,但不宜过多服用(导致兴奋)的药物的是_______;
③是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是_______;
④能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是_______。
(2)2017年11月23日,国产大型喷气式客机C919首架机在航空工业试飞中心完成转场陕西阎良后的首次试飞,标志着C919向取得适航证并最终投入航线运营迈出关键一步。
①机身蒙皮使用的是第三代铝锂合金材料。下列不属于铝锂合金性质的是_______ (填字母)。

A.密度大 B.硬度大 C.抗腐蚀
②飞机轮胎属于橡胶制品。下列材料可用来合成橡胶的是_______ (填字母)。
A.石英砂 B.异戊二烯 C.石灰石
③机体先进复合材料的使用率达12%。下列属于复合材料的是_______ (填字母)。
A.钛合金 B.普通陶瓷 C.玻璃钢
(3)良好的生态环境和科学的饮食可以提升生活质量,根据题意,用下列选项的字母代号填空。
①臭氧层的破坏导致紫外线对地球表面辐射的增加,从而使全球皮肤癌的发病率明显增加。造成这一现象的主要原因是_______;
A.大量使用氟氯烃
B.炼钢时排放了大量高炉煤气
C.石油炼制厂排放了大量的甲烷、氢气
D.硝酸、硫酸工厂排放了大量的二氧化硫和一氧化氮
② 下列说法正确的是_______;
A.为使火腿肠颜色更鲜红,应多加一些亚稍酸钠
B.为摄取足够的蛋白质,应多吃肉、少吃豆制品
C.为减少室内甲醛污染,应提倡居室简单装修
D.为增强婴儿的食欲,应在婴儿食品中多加着色剂
③ 水体污染加剧了水资源的短缺。处理含Hg2+等重金属离子的废水常用的方法是_________;
A.沉淀法 B.中和法 C.蒸馏法 D.混凝法
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A. CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ B. KCl+AgNO3=AgCl↓+KNO3
C. 4NH3+5O2![]() 4NO+6H2O D. CaCO3
4NO+6H2O D. CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氮及其化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图:
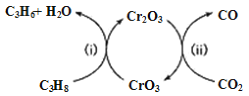
①图中催化剂为__________________。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是______________。
(2)现向三个体积均为2L的恒容密闭容器I、Ⅱ、Ⅲ中,均分别充入1molCO和2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为T1、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为T1、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
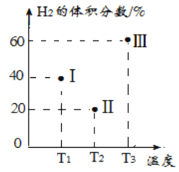
①5min 时三个容器中的反应达到化学平衡状态的是容器__________(填序号)。
②0-5min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_________。(保留两位有效数字)。
③当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器_________。(填序号)
(3)在密闭容器中充入10molCO和8 molNO,发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H=-762kJ·mo-1,如图为平衡时NO的体积分数与温度、压强的关系。
N2(g)+2CO2(g)△H=-762kJ·mo-1,如图为平衡时NO的体积分数与温度、压强的关系。
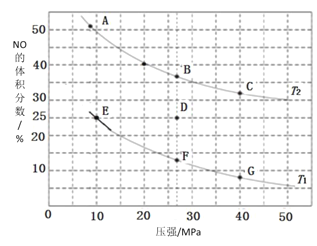
①由上图判断,温度T1_____T2(填“低于”或“高于”)。
②压强为20MPa、温度为T2下,若反应进行到10 min达到平衡状态,在该温度下,如图所示A、B、C对应的pA(CO2)、pB(CO2)、pC(CO2)从大到小的顺序为_________。
③若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的__________点。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组用如下图所示装置A、B分别探究金属铝与稀氢氧化钠溶液的反应,实验过程中装置A中烧杯内的溶液温度升高,装置B中烧杯的电流计指针发生偏转,请回答以下问题。

(1)装置A烧杯中反应的离子方程式为_________。
(2)装置B中Mg上的现象是_________,Al发生的电极反应式是__________________。
(3)当装置B导线中通过0.3mol电子时,装置B烧杯中溶液的质量变化为__________(填增重或减轻多少克)。
(4)该小组同学反思原电池的原理,其中观点正确的是_________(填字母序号)。
A.原电池反应的过程中一定有电子转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
E.原电池的正负极不仅与金属的活动性有关,而且也与电解质溶液有关
查看答案和解析>>
科目: 来源: 题型:
【题目】甲同学向做过银镜反应的试管滴加0.1mol/L的Fe(NO3)3溶液(pH=2),发现银镜部分溶解,和大家一起分析原因:
甲同学认为:Fe3+具有氧化性,能够溶解单质Ag。
乙同学认为:Fe(NO3)3溶液显酸性,该条件下NO3-也能氧化单质Ag。
丙同学认为:Fe3+和NO3-均能把Ag氧化而溶解。
(1)生成银镜反应过程中银氨溶液发生_____________(氧化、还原)反应。
(2)为得出正确结论,只需设计两个实验验证即可。
实验I:向溶解了银镜的Fe(NO3)3的溶液中加入____________(填序号,①KSCN溶液、②K3[Fe(CN)6]溶液、③稀HC1),现象为___________,证明甲的结论正确。
实验Ⅱ:向附有银镜的试管中加入______________溶液,观察银镜是否溶解。
两个实验结果证明了丙同学的结论。
(3)丙同学又把5mLFeSO4溶液分成两份:第一份滴加2滴KSCN溶液无变化;第二份加入1mL0.1mol/LAgNO3溶液,出现白色沉淀,随后有黑色固体产生(经验证黑色固体为Ag颗粒),再取上层溶液滴加KSCN溶液变红。根据上述的实验情况,用离子方程式表示Fe3+、Fe2+、Ag+、Ag之间的反应关系_______________。
(4)丁同学改用如图实验装置做进一步探究:

①K刚闭合时,指针向左偏转,此时石墨作_________,(填“正极”或“负极。此过程氧化性:Fe3+_______Ag+(填>或<)。
②当指针归零后,向右烧杯中滴加几滴饱和AgNO3溶液,指针向右偏转。此过程氧化性:Fe3+_______Ag+(填>或<)。
③由上述①②实验,得出的结论是:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com