
科目: 来源: 题型:
【题目】(14分)近年来,随着锂离子电池的广泛应用,废锂离子电池的回收处理至关重要。下面是利用废锂离子电池正极材料(有Al、LiCoO2、Ni、Mn、Fe等)回收钴、镍、锂的流程图。

已知:P204[二(2乙基己基)磷酸酯]常用于萃取锰,P507(2乙基己基膦酸2乙基己酯)和Cyanex272[二(2,4,4)三甲基戊基次磷酸]常用于萃取钴、镍。
回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式__________________________________。
(2)一些金属难溶氢氧化物的溶解度(用阳离子的饱和浓度表示)与pH的关系图如下:

加入NaOH溶液调pH=5可除去图中的________(填金属离子符号)杂质;写出除去金属离子的离子方程式________________________(一种即可)。
(3)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq)![]() MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)
MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)![]() MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为________________。
MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为________________。
(4)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。

■—Co(Cyanex272);●—Ni(Cyanex272);▲—Co(P507);▼—Ni(P507)
由图可知,钴、镍的萃取率随萃取剂浓度增大而_________(填“增大”或“减小”);两种萃取剂中___________(填“P507”或“Cyanex272”)的分离效果比较好,若选P507为萃取剂,则最适宜的萃取剂浓度大约为__________mol·L1;若选Cyanex272萃取剂,则最适宜的萃取剂浓度大约为___________mol·L1。
(5)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×1016,则沉镍母液中Ni2+的浓度为2.1×1011 mol·L1时,pH=______(lg5=0.7)。
查看答案和解析>>
科目: 来源: 题型:
【题目】印刷电路板在电子行业中应用广泛,其中的铜质线路是通过化学试剂刻蚀覆盖在有机绝缘材料上的铜板形成的。从废弃的印刷电路板上可以回收铜及其化合物。甲、乙、丙三组同学分别采用了不同的回收方案如下(部分产物略去):
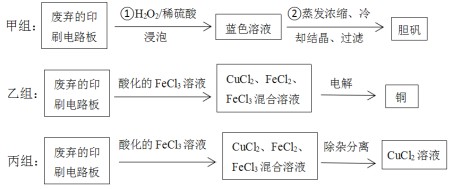
(1)甲组步骤①中反应的离子方程式为:______。
(2)甲组同学进行实验时,发现H2O2已变质不能使用,他们需要在不使用H2O2的前提下实现反应Cu+H2SO4=CuSO4+H2↑。在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”,不能实现的装置中不要填写)。
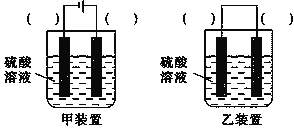
________
(3)乙组同学使用的FeCl3溶液需要酸化的原因是:________。
(4)图为乙组电解时的装置图。其中铜电极应该与电源的_____(填“正极”或“负极”)相连。当观察到阴极有少量气泡产生时,即停止电解,此时要回收的铜已全部析出。则阴极发生的电极反应为(按反应发生的先后顺序书写):_____、___、___。
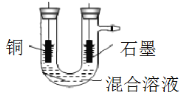
(5)乙组同学用1L 0.2mol/L的FeCl3溶液溶解铜,电解时,阴极产生无色气体0.56L(标准状况下)时停止电解,此时阳极产生的气体在标准状况下的体积共_____L。
(6)丙组同学利用FeCl3腐蚀铜板后的混合液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤(写出试剂和操作)①_____________;②____;③过滤弃去滤渣。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.0 | 9.0 |
Cu2+ | 4.7 | 6.7 |
提供的药品:Cl2、浓硫酸、NaOH溶液、CuO、Cu | ||
查看答案和解析>>
科目: 来源: 题型:
【题目】有机化合物的性质与其所含官能团密切相关,按要求书写指定方程式。
(1)2—丁烯与氯化氢的反应:______;
(2)乙二酸与乙二醇反应生成环状酯:______;
(3)苯甲醛(![]() )与新制Cu(OH)2共热:______;
)与新制Cu(OH)2共热:______;
(4)苦杏仁酸(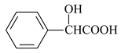 )发生缩聚反应生成的高分子化合物:______;
)发生缩聚反应生成的高分子化合物:______;
查看答案和解析>>
科目: 来源: 题型:
【题目】实验:①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液;②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀;③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色;④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。下列说法中,不正确的是( )
A. 将①中所得浊液过滤,所得滤液中含少量Mg2+
B. 浊液中存在溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
C. 实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D. NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为室温时不同pH下磷酸盐溶液中含磷微粒形态的分布,其中a、b、c三点对应的pH分别为2.12、7.21、11.31,其中δ表示含磷微粒的物质的量分数,下列说法正确的是
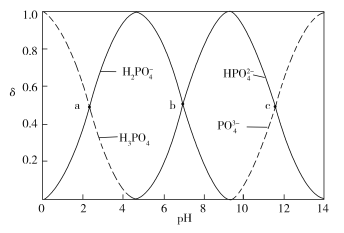
A.2 mol H3PO4与3 mol NaOH反应后的溶液呈中性
B.NaOH溶液滴定Na2HPO4溶液时,无法用酚酞指示终点
C.H3PO4的二级电离常数的数量级为107
D.溶液中除OH离子外,其他阴离子浓度相等时,溶液可能显酸性、中性或碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】将反应Cu(s) + 2Ag+(aq)![]() Cu2+(aq) + 2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是 ( )
Cu2+(aq) + 2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是 ( )
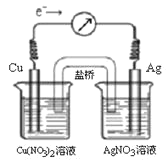
A. KNO3盐桥中的K+移向Cu(NO3)2溶液
B. 当电流计指针为0时,该反应达平衡,平衡常数K=0
C. 若此时向AgNO3溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转
D. 若此时向Cu(NO3)2溶液中加入NaOH固体,随着NaOH量的增加电流计指针向右偏转幅度减小→指针指向0→向左偏转
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验创新小组设计了如图所示的检验Cl2某些性质的一体化装置。下列有关描述不正确的是
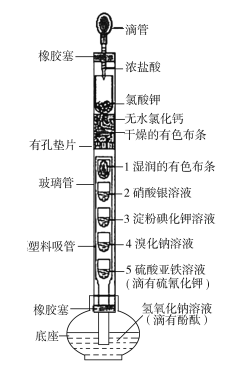
A.浓盐酸滴到氯酸钾固体上反应的离子方程式为5Cl+![]() +6H+===3Cl2↑+3H2O
+6H+===3Cl2↑+3H2O
B.无水氯化钙的作用是干燥Cl2,且干燥有色布条不褪色,湿润的有色布条褪色
C.2处溶液出现白色沉淀,3处溶液变蓝,4处溶液变为橙色,三处现象均能说明了Cl2具有氧化性
D.5处溶液变为血红色,底座中溶液红色消失,氢氧化钠溶液的作用为吸收剩余的Cl2以防止污染
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物E是一种除草剂,常通过如下方法合成:
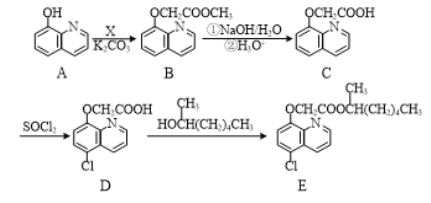
(1)化合物B中的含氧官能团的名称为酯基和_________。
(2)A与X发生反应生成B和HCl,则X的结构简式为_________________。
(3)D→E的反应类型为___________。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式:_____________。
Ⅰ.分子中含有1个苯环,且有5个碳原子位于同一直线上。
Ⅱ.能与新制Cu(OH)2悬浊液反应。
Ⅲ.分子中含有4种化学环境不同的氢。
(5)已知:①CH3CHO![]() ClCH2CHO。②ClCH2CHO也能发生X在流程A→B中的类似反应。
ClCH2CHO。②ClCH2CHO也能发生X在流程A→B中的类似反应。
写出以苯酚和乙醛为原料合成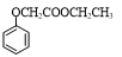 的合成路线流程图(无机试剂可任选)_______________。合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂可任选)_______________。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH溶液滴定0.100mol/L浓度均为0.100mol/L的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是( )
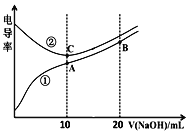
A. 曲线①代表滴定CH3COOH溶液的曲线
B. A、C两点对应溶液均呈中性
C. B点溶液中:c(Na+)>c(OH-)>c(CH3COO-)
D. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物Z是合成治疗某心律不齐药物的中间体:
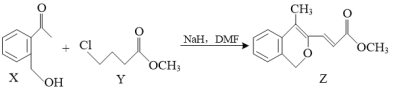
下列说法正确的是( )
A.X中所有原子可能共面
B.X能与金属Na反应,Y能发生消去反应
C.1 mol Z与足量溴水反应,最多消耗1 mol Br2
D.1 mol Y与NaOH水溶液反应,最多消耗2 mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com