
科目: 来源: 题型:
【题目】(13分)硫酸铜晶体(CuSO4·5H2O)是铜盐中重要的无机化工原料,广泛应用于农业、电镀、饲料添加剂、催化剂、石油、选矿、油漆等行业。
Ⅰ.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸(70%)、氨水为原料制取硫酸铜晶体。其工艺流程如下:
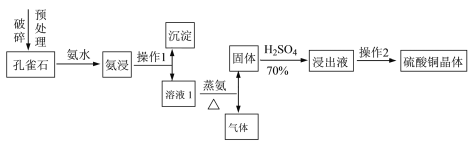
(1)预处理时要用破碎机将孔雀石破碎成粒子直径<1 mm,破碎的目的是____________________。
(2)已知氨浸时发生的反应为CuCO3·Cu(OH)2+8NH3·H2O![]() [Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色,请写出蒸氨时的反应方程式:______________________。
[Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色,请写出蒸氨时的反应方程式:______________________。
(3)蒸氨出来的气体有污染,需要净化处理,下图装置中合适的为___________(填标号);经吸收净化所得的溶液用途是_______________(任写一条)。

(4)操作2为一系列的操作,通过加热浓缩、冷却结晶、___________、洗涤、___________等操作得到硫酸铜晶体。
Ⅱ.采用金属铜单质制备硫酸铜晶体
(5)教材中用金属铜单质与浓硫酸反应制备硫酸铜,虽然生产工艺简洁,但在实际生产过程中不采用,其原因是______________________(任写两条)。
(6)某兴趣小组查阅资料得知:Cu+CuCl2![]() 2CuCl,4CuCl+O2+2H2O
2CuCl,4CuCl+O2+2H2O![]() 2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4
2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4![]() CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置如图:
CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置如图:
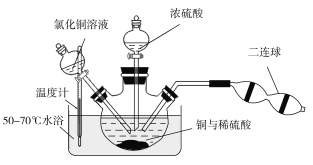
向铜和稀硫酸的混合物中加入氯化铜溶液,利用二连球鼓入空气,将铜溶解,当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸。
①盛装浓硫酸的仪器名称为___________。
②装置中加入CuCl2的作用是______________;最后可以利用重结晶的方法纯化硫酸铜晶体的原因为______________________。
③若开始时加入a g铜粉,含b g氯化铜溶质的氯化铜溶液,最后制得c g CuSO4·5H2O,假设整个过程中杂质不参与反应且不结晶,每步反应都进行得比较完全,则原铜粉的纯度为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1。E原子最外层电子数是D原子最外层电子数的4倍,D的简单离子核外电子排布与C2-相同。

试回答:
(1)元素E在元素周期表中的位置是________。
(2)与元素D的简单离子所含电子数和质子数均相同的微粒是________(用化学式作答,下同)。
(3)B和E的最高价氧化物对应的水化物,酸性较弱的为________。若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ________Ⅱ________,观察到的实验现象是____。
(4)由以上五种元素组成的中学常见的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A、C、D的盐 |
b | C、D组成的化合物,且原子个数之比为1∶1 |
c | 化学组成为AC2 |
①a含有的化学键有____________________________________;
②c的电子式为___________________;
③b与c反应的化学方程式为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中加入CaSO4和CO,在一定温度下,发生反应:CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) ΔH=+218.4 kJ·mol-1
CaO(s)+SO2(g)+CO2(g) ΔH=+218.4 kJ·mol-1

CO的反应速率随时间变化如图所示。下列说法正确的是( )
A.该反应是吸热反应,升高温度,正反应速率增大,逆反应速率减小
B.CaO是固态,不能用CaO表示反应的快慢
C.图示中t1时改变的条件可能是减小c(CO),同时增大c(SO2)
D.图示中t1时改变的条件可能是增大压强
查看答案和解析>>
科目: 来源: 题型:
【题目】向绝热恒容密闭容器中通入![]() 和
和![]() ,一定条件下使反应
,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如图所示
达到平衡,正反应速率随时间变化的示意图如图所示![]() 由图得出的结论不正确的是
由图得出的结论不正确的是
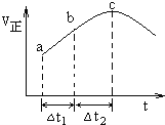
A. 反应过程中压强始终不变
B. 反应物浓度:a点大于b点
C. 反应物的总能量高于生成物的总能量
D. ![]() 时,
时,![]() 的转化率:
的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目: 来源: 题型:
【题目】将如图所示实验装置的K闭合,下列判断正确的是

A. 电子沿Zn→a→b→Cu路径流动
B. 片刻后可观察到滤纸b点变红色
C. 片刻后甲池中c(SO42—)增大
D. Cu电极上发生还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目: 来源: 题型:
【题目】下列描述的化学反应状态,不一定是平衡状态的是( )
A.H2(g)+Br2(g) ![]() 2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B.2NO2(g) ![]() N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s)![]() CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
D.N2(g)+3H2(g) ![]() 2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
查看答案和解析>>
科目: 来源: 题型:
【题目】(12分)人体必需的元素包括常量元素与微量元素,常量元素包括碳、氢、氧、氮、钙、镁等,微量元素包括铁、铜、锌、氟、碘等,这些元素形成的化合物种类繁多,应用广泛。
(1)锌、铜、铁、钙四种元素与少儿生长发育息息相关,请写出Fe2+的核外电子排布式__________。
(2)1个Cu2+与2个H2N—CH2—COO形成含两个五元环结构的内配盐(化合物),其结构简式为_______________(用→标出配位键),在H2N—CH2—COO中,属于第二周期的元素的第一电离能由大到小的顺序是__________(用元素符号表示),N、C原子存在的相同杂化方式是_________杂化。
(3)碳酸盐中的阳离子不同,热分解温度就不同,查阅文献资料可知,离子半径r(Mg2+)=66 pm,r(Ca2+)=99 pm,r(Sr2+)=112 pm,r(Ba2+)=135 pm;碳酸盐分解温度T(MgCO3)=402℃,T(CaCO3)=825℃,T(SrCO3)=1172℃,T(BaCO3)=1360℃。分析数据得出的规律是_____________,解释出现此规律的原因是____________________________________。
(4)自然界的氟化钙矿物为萤石或氟石,CaF2的晶体结构呈立方体形,其结构如下:
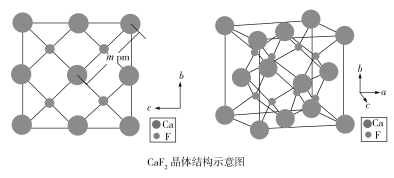
①两个最近的F之间的距离是___________pm(用含m的代数式表示)。
②CaF2晶胞体积与8个F形成的立方体的体积比为___________。
③CaF2晶胞的密度是___________g·cm3(化简至带根号的最简式,NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中进行如下反应:2SO2(g) +O2(g) ![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达平衡时,可能存在的数据是
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.4mol/L
B. SO2为 0.25mol/L
C. SO2、SO3均为0.15mol/L
D. SO3为0.4mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在体积为2 L的密闭容器中混合,并在一定条件下发生反应:2A(g)+B(g) ![]() xC(g),若经2 s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6 mol/L。现有下列几种说法:
xC(g),若经2 s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6 mol/L。现有下列几种说法:
①2 s内用物质A表示的平均反应速率为0.3 mol/(L·s);
②2 s内用物质B表示的平均反应速率为0.15 mol/(L·min)
③2 s时物质B的转化率为70%;
④x=2。
其中正确的是:
A. ①④ B. ②③ C. ①②③ D. ①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com