
科目: 来源: 题型:
【题目】已知:2CrO42-+2H+Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )

A.平衡时,pH越小,c(Cr2O72-)越大
B.A点CrO42-的平衡转化率为50%
C.A点CrO42-转化为Cr2O72-反应的平衡常数K=1014
D.平衡时,若溶液中c(Cr2O72-)=c(CrO42-),则c(H+)>2.0×10-7molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】(15分)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中![]() 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=________min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2/span>)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)
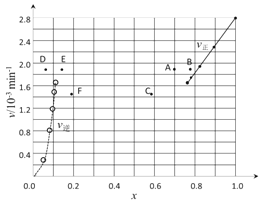
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答
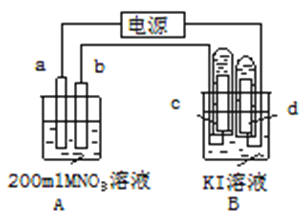
(1)a连接电源的__________极。b极的电极反应式为______________________________。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:_______________,电解进行一段时间后,罩在C极上的试管中也收集到了气体。此时C极上的电极反应式为________________________________
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了__________mol气体,若在b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为___________。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL。取该溶液逐滴加入到25.0mL0.1mol/L HCl溶液中,当加入25.00mL这种溶液时刚好沉淀完全。试计算电解前A烧杯中MNO3溶液的物质的量浓度为__________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方案,不能达到相应实验目的的是
A.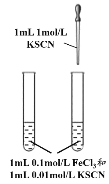 探究反应物浓度对化学平衡的影响
探究反应物浓度对化学平衡的影响
B.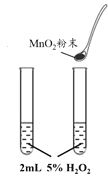 探究催化剂对反应速率的影响
探究催化剂对反应速率的影响
C.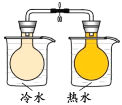 将NO2球浸泡在冷水和热水中,探究温度对化学平衡的影响
将NO2球浸泡在冷水和热水中,探究温度对化学平衡的影响
D. 比较乙醇中羟基氢原子和水分子中氢原子的活泼性
比较乙醇中羟基氢原子和水分子中氢原子的活泼性
查看答案和解析>>
科目: 来源: 题型:
【题目】将3.8 g CO和H2混合气体,在足量的氧气中燃烧,产物全部通过足量的Na2O2,则Na2O2增重
A. 2 g B. 3.8 g C. 5 g D. 无法计算
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.CaCO3溶于CH3COOH溶液中,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O
B.向AlCl3溶液中通入过量NH3,反应的离子方程式为:Al3++4OH-=![]() +2H2O
+2H2O
C.下列四种离子因发生氧化还原反应而不能大量共存:K+、Fe3+、SCN-、Cl-
D.向稀硫酸中滴入Ba(OH)2溶液,反应的离子方程式为:Ba2++2OH-+2H++![]() =2H2O+BaSO4↓
=2H2O+BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
【题目】利用工业废气 CO2 或 CO 和 H2 在一定条件下可制备燃料甲醇。
Ⅰ.利用工业废气 CO 合成甲醇,其能量变化示意图如下:
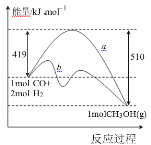
(1)图中曲线 a 到曲线 b 的措施是_______。该反应 ΔS________0(填“>”或“<”)
(2)一定条件下,在 2 L 密闭容器中充入 1 mol CO 和 2 mol H2,10 min 后达到平衡,放出热量 45.5kJ,则 10 min 内 H2 的转化率为_____;该温度下反应的平衡常数 K=_____;达到平衡后,再向容器中充入 CO、H2、CH3OH 各 1 mol,则此时 υ正_____υ逆 (填“>”“<”或“=”)
(3)下列措施可以提高甲醇产率的是_____。
a.压缩容器体积
b.将 CH3OH (g)从体系中分离
c.恒容条件下充入He,使体系总压强增大
d.恒压条件下再充入 10mol CO 和 20mol H2
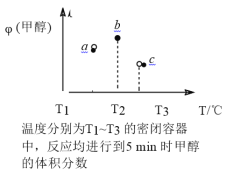
(4)现有容积均为 1L 的 a、b、c 三个密闭容器,向其中分别充入 1molCO 和 2molH2 的混合气体,控制温度,进行反应,测得相关数据的关系如图所示。b 中甲醇体积分数大于 a 中的原因是_______达到平衡时,a、b、c 中 CO 的转化率大小关系为_______。
Ⅱ.用工业废气中的 CO2制取甲醇和水蒸气
(5)一定条件下,往2L恒容密闭容器中充入1mol CO2和3mol H2,在不同催化剂作用下发生反应 I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:
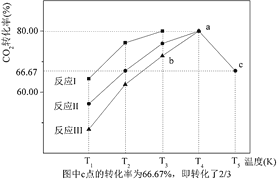
①催化剂效果最佳的反应是_____(填“反应 I”,“反应 II”,“反应 III”)。
②b 点υ正_____υ逆(填 “>”, “<”, “=”)。
③若此反应在 a 点时已达平衡状态,a 点的转化率比 c 点高的原因是_____。
④c点时该反应的平衡常数K=_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中的一定量A、B混合气体发生反应:aA(g)+bB(g)![]() cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
A. a+b=cB. 该变化使平衡正向移动
C. B的转化率降低D. C的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生为探究AgCl沉淀的溶解和转化,其实验方案及记录如下:
步骤和现象 | 现象 |
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合,过滤,得滤液X和白色沉淀Y | |
Ⅱ.向滤液X 中滴加几滴饱和KI溶液 | 生成黄色沉淀M |
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀Y 转化为黑色沉淀Z |
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀Y逐渐溶解 |
(1)由步骤Ⅱ的现象可推测,滤液 X 中除了含有Na+、NO3-,还含有的离子有_____。
(2)写出步骤Ⅲ中生成黑色沉淀 Z 的离子方程式为_________________,白色沉淀Y 转化为黑色沉淀 Z 的主要原因是___________。
(3)已知:Ag+ + 2NH3· H2OAg(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因__________________。
(4)为了进一步探究银的难溶化合物沉淀溶解的多样性,该同学又做了如下对比实验 V:
①取少量黑色沉淀 Z 和黄色沉淀 M,分置于两支试管中
②然后分别滴加同体积同浓度的稀硝酸,观察到黄色沉淀 M 不溶解,黑色沉淀 Z 溶解,并且有无色气体产生。综合实验Ⅱ至实验 V 的信息,下列预测正确的是__________
A.黑色沉淀 Z 比黄色沉淀 M 更难溶于水
B.黑色沉淀 Z 溶解于稀硝酸是因为发生了氧化还原反应
C.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
D.在步骤Ⅳ之后,继续滴加浓硝酸后又有 AgCl 沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
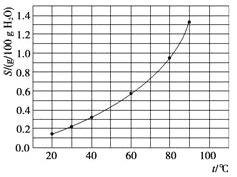
A. 溴酸银的溶解时放热过程
B. 温度升高时溴酸银溶解速度加快
C. 60 ℃时溴酸银的Ksp约等于6×10-4
D. 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com