
科目: 来源: 题型:
【题目】有下列各组物质:A.O2和O3(臭氧);B.![]() 和
和![]() ;
;
C.CH3CH2CH2CH3和![]() ; D.
; D. 和
和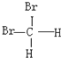 ;
;
E.甲烷和戊烷; F.CH3COOCH3与 CH3CH2COOH;
G.金刚石和石墨; H.液氯与氯气。
(1)_____组两物质互为同位素。
(2)_____组两物质互为同素异形体。
(3)_____组两物质属于同系物。
(4)_____组两组物质互为同分异构体。
(5)_____组中的物质是同一物质。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知碳碳单键可以旋转,结构简式为 ![]() 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A. 分子中最多有6个碳原子处于同一直线上
B. 该烃苯环上的一氯代物有3种
C. 分子中至少有12个碳原子处于同一平面上
D. 该烃属于苯的同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,写出反应方程式______________________。
(2)工业上制取漂白粉的的过程是把氯气通入石灰乳中,写出反应方程__________________。
(3)有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时甲为负极;把乙、丁分别浸入相同浓度的稀硫酸中,乙产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是__________________。
(4)将气体A、B置于容积为2 L的密闭容器中,发生如下反应:4A(g)+B(g)=2C(g),反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol,则:vA=_________,反应前A有_________mol。
(5)第三周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应:______; __________。
(6)碳是周期表中形成化合物最多的元素,写出其单质与浓硫酸反应的方程式___________________写出能验证碳的非金属性弱于硫的化学反应的离子方程式:_____________________,碳还能形成各种有机物,它的一种有机物可由粮食发酵得到,有特殊的香味,有活血壮胆的功效,写出该有机物在某条件下与氧气催化氧化的反应方程式_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钠晶体(Na2Cr2O7·2H2O)俗称红矾钠,是一种重要的化工产品,以FeO·Cr2O3、Na2CO3等为原料制备红矾钠的工艺如图所示。
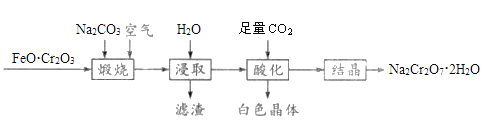
回答下列问题:
(1)FeO·Cr2O3中Cr的化合价是__________。
(2)写出“煅烧”过程发生反应的化学方程式________________________。
(3)滤渣的主要成分为________(填化学式)。
(4)“酸化”过程中发生反应的离子方程式为_____________________________,加入硫酸也能达到“酸化”目的,选择CO2的优点是__________________________________。
(5)称取红矾钠样品1.8000g配成250mL溶液,量取20.00mL于碘量瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钾溶液(铬的还原产物为Cr3+),放于暗处5min,加入淀粉溶液作指示剂,用0.1000moL·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),判断达到滴定终点的现象是______________________________。若实验中平均消耗Na2S2O3标准溶液25.00mL,则重铬酸钠晶体的纯度为______________(设整个过程中其他杂质不参与反应,结果保留4位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】在四个不同的容器中,在不同条件下进行合成氨反应。根据下列在相同时间内测定的结果判断生成氨的速率最快的是
A.v(H2)=0.1 mol·(L·min)-1B.v(N2)=0.1 mol·(L·min)-1
C.v(N2)=0.2 mol·(L·min)-1D.v(NH3)=0.3 mol·(L·min)-1
查看答案和解析>>
科目: 来源: 题型:
【题目】硼氢化钠(NaBH4)通常为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃)。在有机合成中被称为“万能还原剂”。湿法制备硼氢化钠的流程如下:
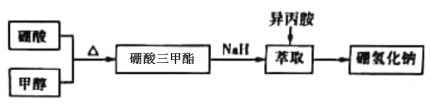
请回答有关问题。
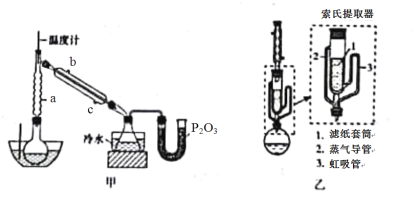
Ⅰ.硼酸三甲酯的制备:将硼酸(H3BO3)和适量甲醇加入圆底烧瓶中,然后缓慢地加入浓硫酸,振荡,在烧瓶上加装分馏柱a,用电炉经水浴锅加热,回流2小时,收集硼酸三甲酯与甲醇共沸液。装置如图甲所示(夹持装置略去,下同)。
已知,相关物质的性质如下表。
硼酸三甲脂 | 甲醇 | 甲醇钠 | |
溶解性 | 与乙醇、甲醇混溶,能水解 | 与水混溶 | 溶于甲醇,不溶于异丙胺 |
沸点/℃ | 68 | 64 | 450 |
硼酸三甲酯与甲醇混合物的共沸点为54℃ | |||
(1)图甲中分馏柱a的作用是___________;直形冷凝管冷却水应从___________(填“b”或“c”)接口进入。
(2)圆底烧瓶中发生的主要反应的化学方程式为________________________。
(3)本实验采用水浴加热,优点是___________________;U型管中P2O3的作用是_________________。
Ⅱ.“萃取”时,可采用索氏提取法,其装置如图乙所示。实验时烧瓶中溶剂受热蒸发,蒸气沿蒸气导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现连续萃取。
(4)萃取完全后,硼氢化钠位于______________(填“圆底烧瓶”或“索氏提取器”)中。
(5)与常规的萃取相比,采用索氏提取法的优点是______________。
Ⅲ.某同学欲通过测定硼氢化钠与水反应生成氢气的体积来测定硼氛化钠产品的纯度(杂质与水不反应)。
(6)硼氢化钠与水反应生成氢气和偏硼酸钠,该反应的化学方程式为______________。
(7)该同学称取0.7 g样品,测得生成气体的体积为1.4 L(已折算为标准状况),则样品中硼氢化钠的纯度为________%(结果保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】高碘酸钾(KIO4)溶于热水,微溶于冷水和氢氧化钾溶液,可用作有机物的氧化剂。制备高碘酸钾的装置图如下(夹持和加热装置省略)。回答下列问题:

(1)装置I中仪器甲的名称是___________。
(2)装置I中浓盐酸与KMnO4混合后发生反应的离子方程式是___________。
(3)装置Ⅱ中的试剂X是___________。
(4)装置Ⅲ中搅拌的目的是___________。
(5)上述炭置按气流由左至右各接口顺序为___________(用字母表示)。
(6)装置连接好后,将装置Ⅲ水浴加热,通入氯气一段时间,冷却析岀高碘酸钾晶体,经过滤,洗涤,干燥等步骤得到产品。
①写出装置Ⅲ中发生反应的化学方程式:___________。
②洗涤时,与选用热水相比,选用冷水洗涤晶体的优点是___________。
③上述制备的产品中含少量的KIO3,其他杂质忽略,现称取ag该产品配制成溶液,然后加入稍过量的用醋酸酸化的KI溶液,充分反应后,加入几滴淀粉溶液,然后用1.0mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液的平均体积为bL。
已知:KIO3+5KI+6CH3COOH===3I2+6CH3COOK+3H2O
KIO4+7KI+8CH3 COOH===4I2+8CH3COOK+4H2O
I2+2Na2S2O3===2NaI+N2S4O6
则该产品中KIO4的百分含量是___________(Mr(KIO3)=214,Mr(KIO4)=230,列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国具有丰富的锑矿资源,锑及其化合物被广泛应用于机械材料、塑料、阻燃剂、微电子技术等领域,具有十分重要的价值。利用脆硫铅锑精矿(主要成分是Sb2S3及PbS)制备锑白(Sb2O3)的工艺流程如图所示。
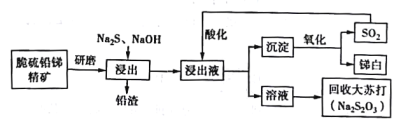
已知:浸出反应Sb2S3+3Na2S = 2Na3SbS3
酸化反应4Na3SbS3 +9SO2=6Na2S2O3+3S↓+2Sb2S3↓
回答下列问题。
(1)精矿进行研磨的目的是___________________。
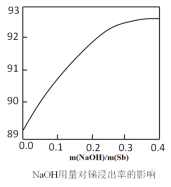
(2)在浸出反应中,浸出率随NaOH用量的变化曲线如图所示,其中NaOH的作用是_______________________。
(3)向浸出液中通入SO2气体进行酸化,得到Sb2S3中间体。酸化反应过程中,pH对锑沉淀率及酸化后溶液中Na2S2O3含量的影响如下表所示,则最适宜的pH为__________。 pH不能过低的原因是_______________(结合离子方程式说明)。
pH | 酸化后溶液成分/(g·L-1) | 锑的沉淀率/% | |
Sb | Na2S2O3 | ||
6 | 0.6 | 160.5 | 99.5 |
7 | 2.7 | 157.6 | 97.5 |
8 | 5.6 | 150.4 | 95.4 |
9 | 10.5 | 145.0 | 92.4 |
(4)浸出液酸化后过滤,得到沉淀混合物,在高温下被氧化,写出所有反应的化学方程式:_____________。
(5)从尾气处理的角度评价该工艺流程在环保方面的优点是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com