
科目: 来源: 题型:
【题目】下列说法中错误的是
A. 从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B. 1 mol金刚石晶体中,平均含有2 mol C—C键
C. 水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键
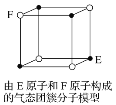
D. 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中“实验内容”与验应“现象或结论”关系都正确的是
选项 | 实验内容 | 实验现象或结论 |
A | 分别往 4 mL 0.01 mol/L 、4 mL 0.02 mol/L KMnO4溶液加入2 mL 0.1 mol/L H2C2O4 溶液,记录褪色时间 | 浓度越大,反应速率越快越先褪色 |
B | 以石墨为电极,电解 KI溶液 (其中含有少量酚酞) | 阴极逸出气体且附近溶液呈现红色 |
C | 25℃时,向 pH=l 的盐酸和醋酸各 0.5L的溶液中各加入 1.4g 铁粉 | 醋酸中生成H2的速率快且最终气体 量多 |
D | 向 FeCl3+3KSCN | 血红色变浅,说明增加生成物浓度, 平衡逆向移动 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用苯、浓H2SO4和浓HNO3 制备硝基苯的实验装置如图所示,发生反应方程式:![]() +HO-NO2→
+HO-NO2→![]() +H2O,下列说法错误的是
+H2O,下列说法错误的是
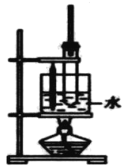
A.反应中浓H2SO4 的作用是催化剂、脱水剂
B.温度计的作用是测水浴的温度,长导管的主要作用是平衡气压
C.实验制得的硝基苯处于混合液的下层
D.从试管内混合物中分离出硝基苯可将反应后的混合物倒入水中,再分液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各项叙述中,正确的是( )
A. 元素周期表每一周期元素原子的最外层电子排布均是从ns1 过渡到ns2np6
B. 若某基态原子的外围电子排布为4d25s2,它是第五周期IVB族元素
C. M层全充满而N层为4s1的原子和位于第四周期第ⅠA族的原子是同一种元素
D. 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1)a、b、c三种元素的原子半径由大到小的顺序是___(填元素符号);b、f、h三种元素对应简单氢化物的热稳定性由强到弱的顺序是___(填化学式)。
(2)c、d、e三种元素最高价氧化物对应水化物中碱性最强的是___(填水化物的化学式)。
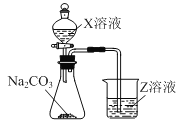
(3)利用如图装置可比较a、e、h的非金属性强弱,则装置中试剂X、Z分别为___(填化学式)。
(4)元素i的原子结构示意图为___;写出元素i的最高价氧化物对应水化物溶液与元素d的单质反应的离子方程式___。
(5)推测原子序数为34的元素在周期表中的位置___。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得。下列有关说法正确的是
A. S2Cl2的电子式为![]()
B. 固态时S2Cl2属于原子晶体
C. S2Cl2与NaOH的化学方程式可能为:S2Cl2+6NaOH=2NaCl+Na2SO3+Na2S+3H2O
D. S2Cl2是含有极性键和非极性键的离子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E均为有机物,其中A是化学实验中常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图甲所示:
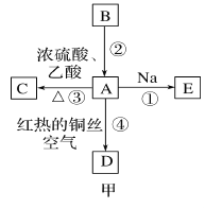
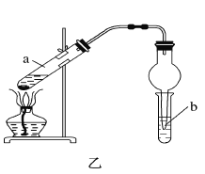
(1)写出B的结构简式________;A中官能团的名称为________。
(2)验证有机物乙酸中含有![]() 所用的试剂是_______,实验现象是_______。
所用的试剂是_______,实验现象是_______。
(3)写出下列反应的化学方程式:
反应①______________;
反应④______________。
(4)实验室利用反应③制取C,常用上图乙装置:
①a试管中主要反应的化学方程式为_________。反应类型是________。
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是__________。
③试管b中观察到的现象是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(I)利用反应CuSO4+Fe===Cu+FeSO4可设计为原电池。
(1)负极材料是________(写名称),电极反应为__________________________________。
(2)正极电极反应式为______________________。
(3)溶液中SO42-向________极移动。
(II)工业合成氨反应:N2+3H2![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。
(4)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总理论数值,其原因是____________________________。
(5)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(6)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等 b.正反应速率最大,逆反应速率为0
c.反应达到最大限度 d.N2和H2的浓度相等
e.生成1 mol N2的同时,消耗2 mol NH3 f.生成3 mol H2的同时,生成2 mol NH3
查看答案和解析>>
科目: 来源: 题型:
【题目】R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
A.若![]() 为强碱,则
为强碱,则![]() 也为强碱
也为强碱
B.若![]() 为强酸,则Y是活泼非金属元素
为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为![]() ,则Z的最高正化合价为
,则Z的最高正化合价为![]()
D.若Ⅹ的最高正化合价为![]() ,则五种元素都是非金属元素
,则五种元素都是非金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com