
科目: 来源: 题型:
【题目】钒和五氧化二钒在工业应用中广泛,某工厂从钒渣中回收金属,钒渣中主要成分有V2O3、FeO,还含有少量的CuO、Al2O3,工艺流程如图:
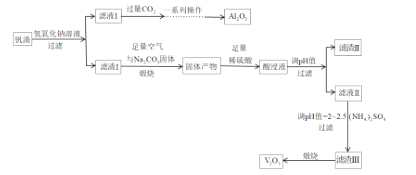
已知:①KspCu(OH)2=1.0×1021;KspFe(OH)3=4.0×1038;KspFe(OH)2=8.0×1016。
②NH4VO3难溶于水,(VO2)2SO4易溶于水。
(1)写出滤液I中加入过量的CO2时发生反应的离子方程式;制取纯净的Al2O3需要经过一系列操作:过滤、___、___。
(2)煅烧时,滤渣I的主要成分V2O3转化为可溶性NaVO3,写出其反应的化学方程式___。
(3)加入稀硫酸后,酸浸液中VO3与VO2+能大量共存的原因是___(用离子方程式解释)。
(4)常温下调节酸浸液的pH=___,即可以完全除去铁、铜两种元素对应的离子___;实际pH值要调整到8,其目的是___;调pH=2~2.5后过滤,滤渣III的主要成分为___。
(5)请写出煅烧滤渣III时,发生反应的化学方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A. Na2CO3和Na2O2 B. Na2CO3和NaOH
C. NaOH和Na2O2 D. NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 工业上用电解法制备烧碱: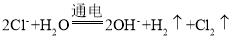
B. 用食醋除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2 O+ CO2↑
C. NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-![]() H2O+NH3↑
H2O+NH3↑
D. 铜溶于硫酸酸化的过氧化氢溶液:Cu+2H++H2O2=Cu2++2H2 O
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)实验室用图甲装置制备SO3并测定SO2催化氧化为SO3的转化率。
已知:SO3熔点为16.8℃,沸点为44.8℃,假设气体进入装置可以被完全吸收,不考虑空气的影响。

(1)A中使用浓硫酸的质量分数为70%的原因是___,B中浓H2SO4的作用是___。
(2)当实验停止通入SO2,熄灭酒精灯后,还需要继续通一段时间的氧气,其目的是___。
(3)实验结束后测得装置D增加了ag,装置E中的沉淀洗涤烘干后其质量为bg。则E中的沉淀的化学成分是___(填写化学式),本实验中SO2转化率为___(用代数式表示,不用化简)。
(二)SO3溶于浓硫酸后可得到发烟硫酸,工业上把干燥的氯化氢气体通入到发烟硫酸中可以得到HSO3Cl。HSO3Cl是一种无色液体,沸点为152℃,有强腐蚀性,遇湿空气产生强烈的白雾。现用图乙所示的装置制取HSO3Cl(夹持及加热装置略去)。

(1)HSO3Cl遇湿空气产生强烈的白雾,请结合用化学方程式解释其原因___。
(2)分液漏斗下方接的毛细管,其作用是___;若不用毛细管而直接用分液漏斗注入浓盐酸,可能发生的现象是___。
(3)装置F的作用是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B为常见的浓酸溶液;X、Y、Z、W均为氧化物,其中X是红棕色气体,Y的固体可用于人工降雨,W既能使澄清石灰水变浑浊,又能使品红溶液褪色。根据如图所示转化关系(反应条件略),回答下列问题:
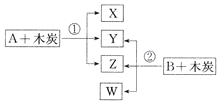
(1)Y是__________(填化学式)。
(2)将B露置在空气中一段时间,溶液质量增加但溶液浓度降低,表明B具有_____性;利用这种性质可以进行______(填字母)实验操作。
![]() 干燥二氧化硫
干燥二氧化硫 ![]() 检验
检验![]() c 干燥氨气
c 干燥氨气 ![]() 钝化铝片
钝化铝片
(3)写出X与Z的反应方程式:________________。
(4)W具有漂白性,氯水也有漂白性,两者同时使用,漂白效果将_________(填“增强”或“减弱”),原因是____________(用化学方程式表示)。
(5)反应①中氧化产物和还原产物的物质的量之比为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】通过计算回答下列问题:
(1)完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱溶液,实验结束后,称得浓硫酸质量增加9g,浓碱溶液质量增加17.6g。该烃的化学式为_____,并写出其所有可能的结构简式:____。
(2)某链状烷烃的相对分子质量为128,该烷烃的化学式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确且与对应操作和目的相符的是
选项 | 目的 | 操作 | 离子方程式 |
A | 比较Fe2+和Br还原性强弱 | 向FeBr2溶液中加入少量氯水 | 2Br+Cl2=Br2+2Cl |
B | 比较C、Si非金属性强弱 | 向硅酸钠溶液中通入少量二氧化碳 | SiO32-+CO2+H2O=H2SiO3↓+ CO32- |
C | 除去CO2中的SO2 | 将气体通入盛有饱和碳酸氢钠溶液的洗气瓶 | CO32-+SO2=SO32-+CO2 |
D | 实验室制取氯气 | 向MnO2固体中加入浓盐酸并加热 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.如图是实验室制乙烯的发生装置和乙烯性质的实验装置,反应原理为CH3CH2OH![]() CH2=CH2↑+H2O,回答下列问题:
CH2=CH2↑+H2O,回答下列问题:

(1)图1中仪器①、②的名称分别为_______、_______。
(2)收集乙烯气体最好的方法是______________。
(3)向溴的四氯化碳溶液中通入乙烯(如图),溶液的颜色很快褪去,该反应属于_______(填反应类型),反应的化学方程式为______________。

Ⅱ.实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。
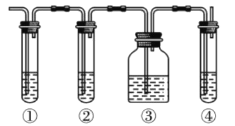
试回答下列问题:
(1)图中①、②、③、④装置盛放的试剂是下列中的(将正确选项填入空格内):
①_______;②_______;③_______;④_______。
A.氢氧化钠溶液 B.浓硫酸溶液 C.酸性高锰酸钾溶液 D.品红溶液
(2)能说明二氧化硫气体存在的现象是__________。
(3)使用装置②的目的是___________。
(4)使用装置③的目的是___________。
(5)确认含有乙烯的现象是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将0.1molL1的NaOH溶液逐渐加到5mL0.1molL1的一元酸HA溶液中,测得混合溶液的BG(BG=-lg![]() )与所加NaOH的体积的变化关系如图所示。
)与所加NaOH的体积的变化关系如图所示。
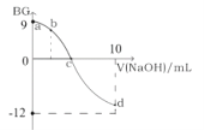
下列叙述错误的是( )
A.该滴定过程可选用酚酞做指示剂
B.c点所加的NaOH溶液的体积小于5mL
C.从a点到c点,水的电离程度一直增大
D.若b点所加的NaOH溶液的体积等于2.5mL,则所得溶液中:c(H+)=c(HA)+c(OH)+c(Na+)
查看答案和解析>>
科目: 来源: 题型:
【题目】将质量均为m g的O2、X、Y气体分别充入相同容积的密闭容器中,压强(P)与温度(T)的关系如图所示,则X、Y气体可能分别是( )
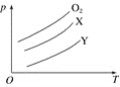
A. C2H4、CH4 B. CO2、Cl2
C. SO2、CO2 D. CH4、Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com