
科目: 来源: 题型:
【题目】I.K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH(未配平)
(1)基态Cr原子的价电子轨道表达式为_________。
(2)甘氨酸的结构简式为NH2CH2COOH,该分子中所含元素的第一电离能由大到小的顺序为___________,碳原子的轨道杂化类型为_______。
(3)已知Cr3+等过渡元素水合离子的颜色如下表所示:
离子 | Sr3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为___________。
Ⅱ.ZnCl2浓溶液常用于除去金属表面的氧化物,如与FeO反应可得 Fe[Zn(OH)Cl2]2溶液。
(4) Fe[Zn(OH)Cl2]2的水溶液中不存在的微粒间作用力有________(填选项字母)。
A 离子键 B 共价键 C 金属键 D 配位键 E 范德华力 F 氢键
Ⅲ.某微粒的球棍模型如下图所示。
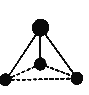
(5)已知含有1个碳原子和3个氢原子,请写出该微粒的化学式:_____。
Ⅳ.铜与氧元素形成的晶胞如下图所示:
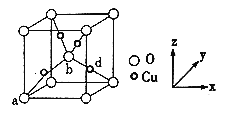
(6)晶胞中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为___________,已知该晶体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为___________cm(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】石棉的化学式可表示为3MgO·2SiO2·2H2O,具有高抗张强度、高挠性耐化学和热浸蚀、电绝缘及具有可纺性的硅酸盐类矿物产品。其中IIA族的元素属于碱土金属。回答下列问题:
(1)与Ca同周期的基态Fe原子的价电子排布式为___________。
(2)BeCl2易升华,液态时以双聚分子存在的BeCl2结构式为___________,其中Be的配位数为___________。
(3)化学式3MgO·2SiO2·2H2O中电负性最大的元素为__________。
SiO2的熔沸点远高于H2O,说明理由:____________________________________________。
(4)天然硅酸盐组成复杂,阴离子的基本结构单元是SiO44-四面体,如图(a),通过共用顶角氧离子可形成链状、网状等结构,图(b)为一种无限长双链的多硅酸根,其中O与Si的原子数之比为___________,化学式为___________。
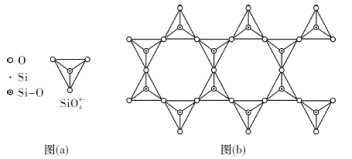
(5)经X射线分析鉴定,某一离子晶体属于立方晶系。晶胞顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占,写出此晶体的化学式:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国古代在冶炼金属方面成就显著,请回答:
(1)商代司母戊鼎属于_____(选填“青铜”、“铁合金”或“铝合金”)制品。
(2)下图为铜及其化合物之间的转化关系(反应条件略去):
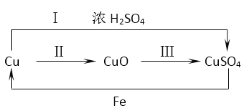
①上述转化常伴随颜色的变化,紫红色的铜与氧气反应生成______色的氧化铜;
②“曾青得铁则化为铜”体现了我国古代湿法炼铜的原理,其中的反应有:Fe + CuSO4 = FeSO4 + Cu,由此可知铁比铜的金属活动性________(选填写“强”或“弱”);
③为验证铜和浓硫酸反应生成的气体,将气体通入品红溶液,观察到的现象是_______;
④由上图可知,制备硫酸铜可以用途径甲(反应Ⅰ)或途径乙(反应Ⅱ+Ⅲ),从环保角度考虑,应选择途径________(选填“甲”或“乙”),理由是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。
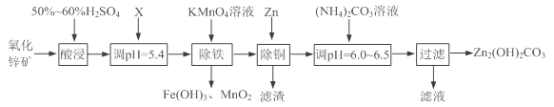
(1)“酸浸”时保持H2SO4过量的目的是___________。
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式:___________。
②流程中调节pH=5.4所加试剂X为____(填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由_____。
(3)上述流程中滤渣的成分为___________(写化学式);“滤液”可以用作化肥,该滤液的主要成分为___________(填化学式)。
(4)检验Zn2(OH)2CO3是否洗涤干净的方法是___________。
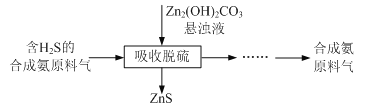
(5)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2,CaC2再与水反应即得到乙炔。CaC2与水反应的化学方程式为____
(2)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(1) △H1=-890.3kJ/mol
C2H2(g)+2.50(g)===2CO2(g)+H2O(1) △H2=-1299.6J/mol
2H2(g)+O2(g)=2H2O(1) △H3=-571.6kJ/mol
则甲烷气相裂解反应:2CH4(g)===C2H2(g)+3H2(g)的△H=_____kJ/mol。
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
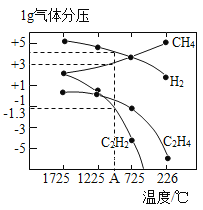
①T1℃时,向1L恒容密闭容器中充入0.3 mol CH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____0(填“>”或“<”),CH4的平衡转化率为____%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>”或“<”)T2,t=______s。
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____0(填“>”或“<”),CH4的平衡转化率为____%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>”或“<”)T2,t=______s。
②列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=____(用平衡分压代替平衡浓度计算,lg0.05=-1.3)。
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=____(用平衡分压代替平衡浓度计算,lg0.05=-1.3)。
③由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题:
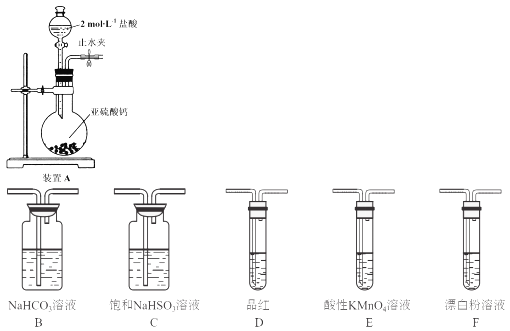
(1)装置A中反应的化学方程式为___________。
(2)使分液漏斗中液体顺利流下的操作是___________。
(3)选用上面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按照A→C→F的顺序连接装置即可证明,乙同学认为该方案不合理,其理由是___________。
②丙同学设计的合理实验方案为:A→C→_____→___→D→F,其中装置C的作用是_____,证明亚硫酸的酸性强于次氯酸的实验现象是____。
(4)K2S2O3具有强氧化性,可通过电解H2SO4和K2SO4的混合溶液制得,其阳极反应式为_____。称取0.2500g产品于碘量瓶中,加100mL水溶解,再加入8.000g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以淀粉为指示剂,用cmol/L的Na2S2O3标准液滴定至终点,消耗Na2S2O3标准液VmL,则样品中K2S2O8的纯度为______%(用含c、V的代数式表示,已知:S2O82-+2I-=2SO42-+I2;2S2O32-+I2=S4O62-+2I-)。
查看答案和解析>>
科目: 来源: 题型:
【题目】按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为所期望的最终产物,原子利用率为100%。下列制备CH3CH2OH的反应中符合“原子经济”要求的是( )
A.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
B.CH3COOCH2CH3+H2O![]() CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
C.C6H12O6(葡萄糖) ![]() 2CH3CH2OH+2CO2↑
2CH3CH2OH+2CO2↑
D.CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl
CH3CH2OH+NaCl
查看答案和解析>>
科目: 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]是一元强碱。常温下,向20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液、氨水中分别滴加0.1mol·L-1盐酸,溶液导电性如图所示(已知:溶液导电性与离子浓度相关)。下列说法正确的是
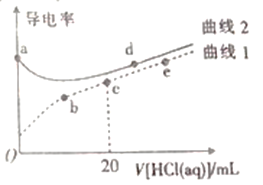
A. 在a、b、c、d、e中,水电离程度最大的点是d
B. c点溶液中:c(H+)=c(OH-)+c(NH3·H2O)
C. 曲线I中c与e之间某点溶液呈中性
D. a点溶液pH=12
查看答案和解析>>
科目: 来源: 题型:
【题目】叠氮化钠(NaN3)是制备医药、炸药的一种重要原料,采用“亚硝酸甲酯-水合肼法”制备叠氮化钠的生产流程如下:
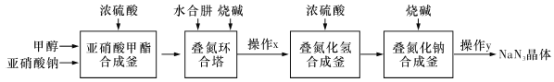
回答下列问题:
(1)亚硝酸甲酯合成釜中生成的亚硝酸甲酯(CH3ONO)易转化为气态进入叠氮环合塔,写出生成CH3ONO的化学反应方程式:_________________________________________________。
(2)叠氮环合塔中生成叠氮化钠的过程中生成一可循环使用的有机物,其官能团电子式为___________,该合成过程的化学方程式为______________________________________。
(3)已知氨基、氨气因有孤对电子而呈现一定碱性,所以水合肼(N2H4·H2O)的性质类似一水合氨,将硫酸与水合肼反应可以生成酸式盐,该盐的化学式为___________;叠氮环合塔中滴加的烧碱溶液要适当过量,目的主要是_________________________________。
A.促进NaN3水解 B抑制NaN3水解 C.作催化剂且对NaN3水解无影响
(4)生产中有HN3生成,请设计实验证明HN3为弱酸:________________________________。
(5)化工生产中,多余的NaN3常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理13 g NaN3,理论上需加入0.5 mol·L-1的NaClO溶液___________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知甲醇分解反应:CH3OH(g)![]() CO(g)+2H2(g) △H1=+90.64 kJ·mol-1;
CO(g)+2H2(g) △H1=+90.64 kJ·mol-1;
水蒸气变换反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.20 kJ·mol-1。
CO2(g)+H2(g) △H2=-41.20 kJ·mol-1。
则CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H3=___________kJ·mol-1。
CO2(g)+3H2(g) △H3=___________kJ·mol-1。
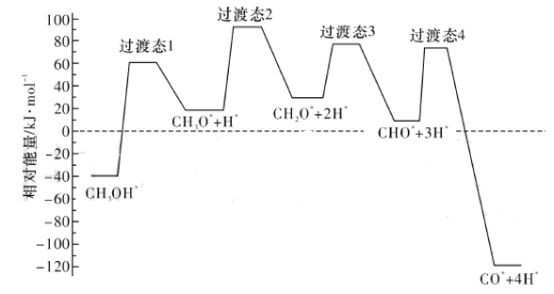
(2)科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(III)表面发生解离时四个路径与相对能量的关系如图所示,其中附在Pd(III)表面的物种用*标注。此历程中活化能最小的反应方程式为_____________________________________________。
(3)在0.1MPa下,将总进料量为1 mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
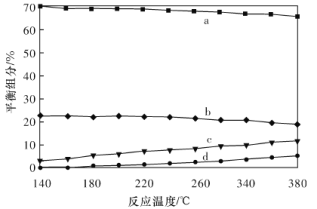
①实验测得水蒸气变换反应的速率随温度的升高明显下降,原因是____________________。
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分的含量与反应温度的关系如图所示,曲线b、c对应物质的化学式分别为________、________。
(4)573.2K时,向一刚性密闭容器中充入5.00 MPa CH3OH使其分解,t h后达平衡时H2的物质的量分数为60%,则t h内v(CH3OH)=_____MPa·h-1,其分压平衡常数Kp=_____MPa2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com