
【题目】石棉的化学式可表示为3MgO·2SiO2·2H2O,具有高抗张强度、高挠性耐化学和热浸蚀、电绝缘及具有可纺性的硅酸盐类矿物产品。其中IIA族的元素属于碱土金属。回答下列问题:
(1)与Ca同周期的基态Fe原子的价电子排布式为___________。
(2)BeCl2易升华,液态时以双聚分子存在的BeCl2结构式为___________,其中Be的配位数为___________。
(3)化学式3MgO·2SiO2·2H2O中电负性最大的元素为__________。
SiO2的熔沸点远高于H2O,说明理由:____________________________________________。
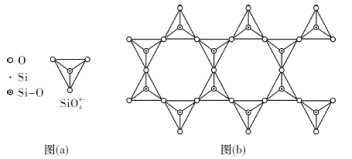
(4)天然硅酸盐组成复杂,阴离子的基本结构单元是SiO44-四面体,如图(a),通过共用顶角氧离子可形成链状、网状等结构,图(b)为一种无限长双链的多硅酸根,其中O与Si的原子数之比为___________,化学式为___________。
(5)经X射线分析鉴定,某一离子晶体属于立方晶系。晶胞顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占,写出此晶体的化学式:___________。
【答案】3d54s2 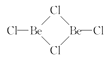 3 O SiO2为原子晶体,H2O为分子晶体 2:5.5 [Si4O11]n6n- BaTiO3
3 O SiO2为原子晶体,H2O为分子晶体 2:5.5 [Si4O11]n6n- BaTiO3
【解析】
(1)与Ca同周期的基态Fe原子的价电子排布式为3d54s2。故答案为:3d54s2;
(2)由BeCl2易升华可知BeCl2的共价性强,其单分子结构为Cl-Be-Cl,(BeCl2)2中Be与Cl之间可形配位键,其双聚分子结构式为 ,Be在双聚分子中,形成三个共价键,可知其配位数为3,故答案为:
,Be在双聚分子中,形成三个共价键,可知其配位数为3,故答案为: ;3;
;3;
(3)化学式3MgO·2SiO2·2H2O中电负性最大的元素为O;SiO2的熔沸点远高于H2O,说明理由:SiO2为原子晶体,H2O为分子晶体。故答案为:O;SiO2为原子晶体,H2O为分子晶体;
(4)n个SiO2通过共用顶角氧离子可形成双链结构,找出重复的结构单元,如图: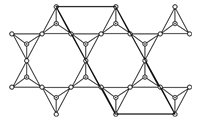 ,由于是双链,其中顶点氧占
,由于是双链,其中顶点氧占![]() ,Si原子数为4×
,Si原子数为4×![]() +6×
+6×![]() +4+2=11,其中Si与O的原子数之比为2:5.5,化学式为[Si4O11]n6n-。故答案为:2:5.5;[Si4O11]n6n-;
+4+2=11,其中Si与O的原子数之比为2:5.5,化学式为[Si4O11]n6n-。故答案为:2:5.5;[Si4O11]n6n-;
(5)经X射线分析鉴定,某一离子晶体属于立方晶系。晶胞顶点位置为Ti4+所占,8×![]() =1,体心位置为Ba2+所占,所有棱心位置为O2-所占,12×
=1,体心位置为Ba2+所占,所有棱心位置为O2-所占,12×![]() =3,如图
=3,如图 ,此晶体的化学式:BaTiO3。故答案为:BaTiO3。
,此晶体的化学式:BaTiO3。故答案为:BaTiO3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是

A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:![]()
![]()
![]() +H2(g)
+H2(g)
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应生成1mol氢气的热效应___(填吸放多少kJ)
(2)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图。
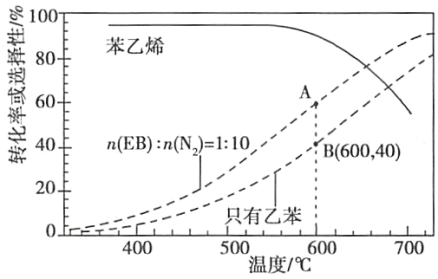
①A、B两点对应的正反应速率较大的是___。
②控制反应温度为600℃的理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是
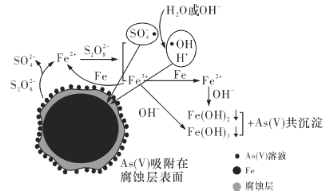
A.1 mol过硫酸钠(Na2S2O8)含2NA个过氧键
B.若56 g Fe参加反应,被还原的S2O82-大于NA个
C.室温下,中间产物Fe(OH)3溶于水所得饱和溶液中(假设pH接近7)c(Fe3+)为2.7×10-32 mol·L-1
D.pH越小,越有利于去除废水中的正五价砷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为所期望的最终产物,原子利用率为100%。下列制备CH3CH2OH的反应中符合“原子经济”要求的是( )
A.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
B.CH3COOCH2CH3+H2O![]() CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
C.C6H12O6(葡萄糖) ![]() 2CH3CH2OH+2CO2↑
2CH3CH2OH+2CO2↑
D.CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl
CH3CH2OH+NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,5.6LO2含有4NA个电子
B. 28gN2、CO和C2H4的混合气体分子总数为NA
C. 标准状况下,22.4L盐酸含有NA个HCl分子
D. 1molNa被完全氧化生成Na2O2,失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置进行实验,仪器![]() 、
、![]() 、
、![]() 中分别盛有试剂1、2、3,其中能达到实验目的是( )
中分别盛有试剂1、2、3,其中能达到实验目的是( )
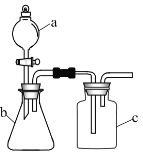
选项 | 试剂1 | 试剂2 | 试剂3 | 实验目的 |
A | 浓盐酸 |
| 饱和食盐水 | 制备 |
B | 浓硫酸 | 乙醇 | 溴水 | 验证乙烯能使溴水褪色 |
C | 盐酸 |
| 品红试液 | 证明 |
D | 稀硫酸 | 溶液 | 澄清石灰水 | 验证 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种线性高分子,结构如下图所示。
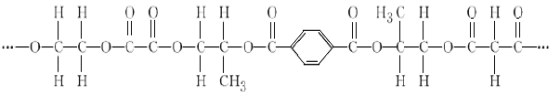
完成下列填空:
(1)该高分子由______种单体(聚合成高分子的简单小分子)聚合而成。
(2)写出上述单体中相对分子质量最小和相对分子质量最大的分子间发生缩聚反应的化学方程式__________________________________________________。
(3)上述单体中相对分子质量最小的分子在一定条件下完全消去后所得物质的结构简式为 。该物质加聚生成的高分子(填“能”或“不能”)________与溴的CCl4溶液发生加成反应。该物质三分子聚合成环,所得物质的名称是_______。
(4)上述单体中其中互为同系物的是(写出所有可能,用结构简式表述) 。
(5)与上述单体中相对分子质量最大的物质互为同系物,且相对分子质量多14的结构有___种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)是一种工业化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用O2和PCl3为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
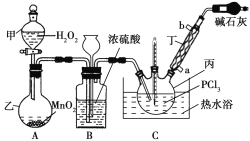
已知PCl3和三氯氧磷的性质如表:
熔点/℃ | 沸点/℃ | 其他物理或化学性质 | |
PCl3 | -112.0 | 76.0 | PCl3和POCl3互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和HCl |
POCl3 | 1.25 | 106.0 |
(1)装置A中的分液漏斗能否用长颈漏斗代替?做出判断并分析原因:_______
(2)装置B的作用是______________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
(3)仪器丙的名称是___________,实验过程中仪器丁的进水口为__________(填“a”或“b”)口。
(4)写出装置C中发生反应的化学方程式_______,该装置中用温度计控制温度为60~65 ℃,原因是________。
(5)称取16.73 g POCl3样品,配制成100 mL溶液;取10.00 mL溶液于锥形瓶中,加入3.2 mol·L-1的AgNO3溶液10.00 mL,并往锥形瓶中滴入5滴Fe2(SO4)3溶液;用0.20 mol·L-1的KSCN溶液滴定,达到滴定终点时消耗KSCN溶液10.00 mL(已知:Ag++SCN-=AgSCN↓)。则加入Fe2(SO4)3溶液的作用是________,样品中POCl3的纯度为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com