
科目: 来源: 题型:
【题目】下列解释事实的离子方程式中,不正确的是( )
A.向FeCl2溶液中通入氯气,溶液变为黄色:2Fe2++Cl2=2Fe3++2Cl-
B.向铜粉中滴加稀硝酸,产生气体:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C.向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++2OH-=Cu(OH)2↓
D.Na2O2是重要的供氧剂:2Na2O2+2H2O=4Na++4OH-+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】对羟基苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得,以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:
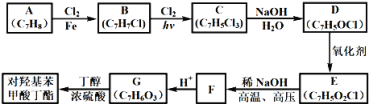
已知以下信息:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;②D可与银氨溶液反应生成银镜;③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1﹕1。
回答下列问题:
(1)A的化学名称为________;
(2)由B生成C的化学反应方程式为_______,该反应的类型为_______;
(3)D的结构简式为________;
(4)F的分子式为_______;
(5)G的结构简式为________;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有_______种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2﹕2﹕1的是______(写结构简式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】由硫铁矿“烧渣”(主要成分:Fe3O4、Fe2O3和FeO)制备绿矾(FeSO4·7H2O))的流程如图:

已知:FeS2(S的化合价为-1)难溶于水。
(1)①中加入的酸为___,滤渣2的主要成分是___。
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、___。
(3)检验②中Fe3+已经完全转化成Fe2+的实验方法:取适量溶液2,___。
(4)通过③得到绿矾晶体的实验操作:加热浓缩、冷却结晶、___。
查看答案和解析>>
科目: 来源: 题型:
【题目】氟化钙材料具有良好的透光性和较低的折射率,可用做紫外和红外光学元件、不可见光谱范围内的消色差镜头。如图为氟化钙晶胞,其中小球代表Ca2+,大球代表F-。
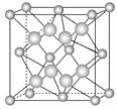
(1)每个晶胞实际含有________个Ca2+和________个F-。
(2)氟化钙晶体可以看作Ca2+按__________堆积排列,F-填入Ca2+堆积的部分空隙中。每个Ca2+周围有__________个F-,而每个F-周围有_________个Ca2+,每个F-周围与其距离最近的F-的数目是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】与![]() 互为同分异构体的是( )
互为同分异构体的是( )
A.OHCCH2CH2CHOB.CH3CH2OCH2CH2OH
C.CH3CH=CHCOOHD.HOCH2CH=CHCH2OH
查看答案和解析>>
科目: 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成![]() ,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
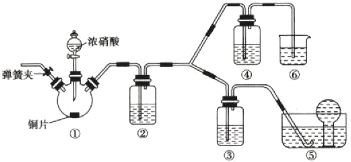
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与![]() 反应:
反应:![]() 。
。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是_______________________________________。
(2)滴加浓硝酸之前的操作是检查装置的气密性,加入药品,打开弹簧夹后_______________________________________。
(3)装置①中发生反应的化学方程式是____________________________________________。
(4)装置②的作用是_____________________,发生反应的化学方程式是________________________________________。
(5)该小组得出的结论所依据的实验现象是_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,某恒容密闭容器中含有NO2、N2O4两种气体,反应开始至达到平衡状态过程中,两种物质的浓度随时间的变化如下所示。

(1)表示NO2浓度变化的曲线是_____,写出相应的化学方程式:____________________。
(2)从反应开始至达到平衡的过程中,用N2O4表示的反应速率v(N2O4)=_____,a、b两点对应状态中,曲线X代表的物质的反应速率相对大小为v(a)_____v(b)。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃料电池具有能量利用率高、可连续使用和污染轻等优点,已成为一种发展前景十分广阔的化学电源。氢氧燃料电池是目前最成熟的燃料电池,它可以使用不同的电解质,如酸式、碱式、熔融碳酸盐、固体电解质等。回答以下问题。
(1)通人氧气的一极为___________极,若电解质溶液为硫酸溶液,负极反应式为____________,若电解质溶液为KOH溶液,正极反应式为____________。
(2)若将氢气改为CH4,电解质溶液为KOH溶液,此时负极反应式为__________,一段时间后,电解质溶液的OH-的浓度将____________(填“增大”“减小”或“不变”)。
(3)肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%30%的KOH溶液。已知N2H4燃烧产物之一为空气中含量最高的一种气体。肼-空气燃料电池放电时负极的电极反应式为___________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学要以“研究苯分子的结构”为题目做一次探究活动,下面是其活动记录,请你补全所缺内容。
(1)理论推测:他根据苯的凯库勒式________,推测苯分子中有两种不同的碳碳键,即________和________,因此它能使紫色的________溶液褪色。
(2)实验验证:他取少量的上述溶液加入试管中,然后加入苯,充分振荡,发现_____________________。
(3)实验结论:上述的理论推测是________(填“正确”或“错误”)的。
(4)查询资料:经查阅有关资料,发现苯分子中六个碳原子之间的键________(填“相同”或“不同”),是一种特殊的键,苯分子中的六个碳原子和六个氢原子________(填“在”或“不在”)同一个平面上,应该用________表示苯分子的结构更合理。
(5)发现问题:当他将苯加入溴水中时,充分振荡,发现能使溴水褪色,于是该同学认为所查资料有误。你同意他的结论吗?____。为什么?______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com