
科目: 来源: 题型:
【题目】下图是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )

A. c(H+) B. V(H2) C. m(溶液) D. m(Cu)
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
Ⅰ.已知:①2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0 kJ·mol-1
②N2(g)+O2(g)=2NO(g) ΔH2=+180.5 kJ·mol-1
③2NO(g)+O2(g)=2NO2(g) ΔH3=-116.5 kJ·mol-1
(1)CO的燃烧热为______________。
(2)若1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g)分子中化学键断裂时需吸收的能量为________。
Ⅱ.利用水煤气合成二甲醚的总反应为:
3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g) ΔH=-246.4 kJ·mol-1
(3)它可以分为两步,反应分别如下:
①2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH1=-205.1 kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=________。
(4)已知CH3OCH3(g)的燃烧热为1455 kJ·mol-1,写出表示其燃烧热的热化学方程式:_________________________________。若二甲醚燃烧生成的CO2恰好能被100 mL 0.2 mol·L-1 NaOH溶液吸收生成Na2CO3,则燃烧过程中放出的热量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究燃料的燃烧效率和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g) = H2O(g) ![]() H= 242.0 kJ/mol
H= 242.0 kJ/mol
C(s)+1/2O2(g) = CO(g) ![]() H= 110.0 kJ/mol
H= 110.0 kJ/mol
①写出焦炭与水蒸气反应制H2和CO的热化学方程式_____________________。
②已知在101kPa时,CO、 H2和CH4的燃烧热分别为283kJ/mol、286 kJ/mol和892kJ/mol,H2O(l)= H2O(g) △H= +44.0 kJ/mol,则反应CH4(g)+ H2O(g) ![]() CO(g)+3H2(g)△H=______________。
CO(g)+3H2(g)△H=______________。
(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:CO(g)+2H2(g)![]() CH3OH(g)△H=-91kJ/mo1
CH3OH(g)△H=-91kJ/mo1
①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是_____________。
A.2mo1 CO和4mol H2 B.2mo1 CO、4mol H2和1mol CH3OH(g)
C.4mo1 CO和4mol H2 D.4mo1 CO和6mol H2
②将1mol CO和2mol H2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%,反应达到平衡时的热量变化是___(填“吸收”或“放出”)___kJ热量。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2 ②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则 ΔH2=____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧燃料电池已用于航天飞机,其工作原理如图所示。关于该燃料电池的说法不正确的是
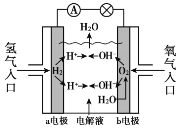
A. H2在负极发生氧化反应
B. 电子从a电极经外电路流向b电极
C. 供电时的总反应为:2H2 + O2 == 2H2O
D. 燃料电池的能量转化率可达100%
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL0.50mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,混合均匀,测得混合液最高温度。
回答下列问题:
(1)写出该反应的热化学方程式(已知生成lmol液态水的反应热为-57.3kJ/mol)______________________。
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1L1mol/L盐酸恰好完全反应,其反应热分别为H1、H2、H3,则H1、H2、H3的大小关系为________________________。
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和反应后生成溶液的比热容c=4.18J/(g·℃),为了计算中和热,某学生实验记录数据如表:
实验序号 | 起始温度 | 终止温度 | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.4 | 20.6 | 23.6 |
4 | 20.1 | 20.3 | 26.9 |
依据该学生的实验数据计算,该实验测得的中和热H_____(结果保留一位小数)。
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量__________ (填“相等、不相等”),所求中和热__________(填“相等、不相等”)。
(5)利用简易量热计测量室温下盐酸与氢氧化钠溶液中和反应的反应热,下列措施不能提高实验精度的是(_______)
A.利用移液管(精确至0.01 mL)代替量筒(精确至0.1 mL)量取反应液
B.快速将两溶液混合,匀速搅拌并记录最高温度
C.在内、外筒之间填充隔热物质,防止热量损失
D.用量程为500℃的温度计代替量程为100℃的温度
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组为验证NO2与水反应的产物,用如图所示装置进行实验(夹持装置已略去,气密性已检验)。
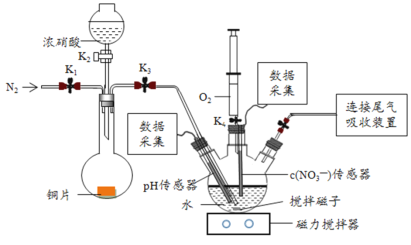
(实验过程)
实验步骤 | 实验现象 |
Ⅰ.打开K1、K3、K5,关闭K2、K4,通入一段时间N2,关闭K1 | —— |
Ⅱ.打开K2,放入足量浓HNO3,同时打开pH传感器和NO3-传感器,记录数据 | 圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色, ;片刻后,三颈瓶内的导管口有气泡冒出 |
III.5min后,打开K4,用注射器将少量空气注入三颈瓶,关闭K4 | 三颈瓶内的气体从无色变为浅红棕色 |
步骤II中,传感器记录数据如图所示:
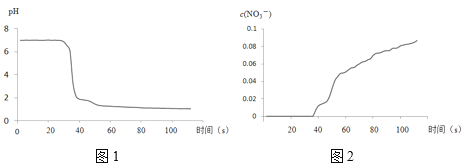
(解释及结论)
(1)NO2与水反应的离子方程式为___。
(2)步骤I中,通入N2的目的是___。
(3)将步骤II中圆底烧瓶内的实验现象补充完整:___。
(4)该实验验证NO2与水反应产物的实验证据包括___(填序号)。
A.圆底烧瓶中溶液变为蓝绿色
B.三颈瓶内的气体从无色变为浅红棕色
C.pH传感器记录所得数据
D.NO3-传感器记录所得数据
(5)有同学认为该实验不严谨,因为也可能导致传感器所记录的数据结果___。
查看答案和解析>>
科目: 来源: 题型:
【题目】一些烷烃的燃烧热如下表:

下列说法正确的是( )
A. 正戊烷的燃烧热大约是-3 540 kJ·mol-1
B. 热稳定性:正丁烷>异丁烷
C. 乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ΔH=-1 560.8 kJ·mol-1
D. 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B.AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1的KCl,无沉淀析出
D.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
查看答案和解析>>
科目: 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是

A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol
查看答案和解析>>
科目: 来源: 题型:
【题目】选择装置,完成实验。
|
|
|
|
① | ② | ③ | ④ |
(1)分离水和植物油,选用___(填序号,下同)。
(2)配制100mL0.1mol·L-1NaOH溶液,选用___。
(3)鉴别Na2CO3和NaHCO3固体,选用__。
(4)用乙酸、乙醇和浓硫酸制备乙酸乙酯,选用__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com